Ergebnisse
Polarität von MT und Eigenschaften der MTOCs
Mikrotubuli weisen physiologisch unterschiedliche Enden auf, die sich in ihren Polymerisationseigenschaften erheblich unterscheiden (Kowalski & Williams, 1993; Erickson & O'Brien, 1992; Avila, 1990; Cassimeris et al., 1994). Da die Richtung des cytoplasmatischen Transports von den Motorproteinen selbst und von der Polarität der MT abhängig ist (Review in Walker & Sheetz, 1993), Schliwa et al. (1991) jedoch bei Reticulomyxa ein cytoplasmatisches Motorprotein gefunden haben, das keine bevorzugte Transportrichtung zu haben scheint, ist eine Klärung der MT-Polarität sowie von Art und Lage der bislang noch nicht charakterisierten Mikrotubuli-organisierenden Zentren bei diesem Objekt sehr wünschenswert.
Hook-Dekoration
[EM-Bilder] Neben der Markierung mit isoliertem Flagellendynein (Haimo, 1982) ist die Dekoration bestehender MT mit Tubulin die zweite, weiter verbreitete Möglichkeit, die Polarität von MT auf ultrastruktureller Basis darzustellen. Nach Heidemann & McIntosh (1980) polymerisiert bei dieser Technik zugefügtes Tubulin zuerst zu Protofilamenten, die sich dann an bestehende Mikrotubuli anlagern und blattförmige Anhänge bilden, deren Krümmung im Querschnitt die Polarität der MT anzeigt. Ausschlaggebend für das Gelingen der Technik ist eine Anpassung an das Versuchsobjekt hinsichtlich der Lysis- und Polymerisationsbedingungen (Heidemann, 1991).
Wie die folgende Tabelle zeigt, ließen sich bei Reticulomyxa filosa auch nach Anpassung der meisten Parameter an das Objekt nicht alle Mikrotubuli markieren. Zwar sind 23% der Mikrotubuli in irgendeiner Form mit Hirntubulin dekoriert (vgl. Abb. 3 bis 6), aber viele Aggregate (z.B.: Abb. 4 und 5) sind im Querschnitt nicht eindeutig häkchenförmig oder weisen keine definierte Drehrichtung auf. Die Häufigkeit und Komplexität der Aggregate nahm bei steigender Konzentration von Tubulin oder EGTA zu.
| Bündel Nr. | Anzahl MT | davon dekoriert | ||
|---|---|---|---|---|
| insgesamt | rechte Hooks | linke Hooks | ||
| 1 | 24 | 4 | 1 | 0 |
| 2 | 87 | 17 | 4 | 1 |
| 3 | 74 | 28 | 2 | 8 |
| 4 | 64 | 26 | 4 | 5 |
| 5 | 59 | 19 | 3 | 3 |
| 6 | 58 | 18 | 1 | 1 |
| 7 | 19 | 3 | 0 | 0 |
| 8 | 15 | 3 | 0 | 0 |
| 9 | 41 | 11 | 0 | 4 |
| 10 | 136 | 26 | 2 | 2 |
| 11 | 26 | 4 | 2 | 0 |
| 12 | 985 | 228 | 7 | 27 |
| 13 | 329 | 70 | 4 | 16 |
| 14 | 129 | 30 | 1 | 5 |
| 15 | 309 | 74 | 3 | 4 |
| Summe | 2.355 | 561 | 34 | 76 |
| Prozentsatz | := 100% | 23,82 | 1,44 | 3,23 |
Tabelle 7: Häufigkeit von dekorierten MikrotubuliIn einigen Schnitten wurden die gefundenen MT-Bündel willkürlich numeriert und die Häufigkeit von MT, Tubulin-Aggregaten und eindeutigen Hooks wurde bestimmt. Es zeigt sich, daß zwar ungefähr ein Viertel der vorhandenen MT mit Hirntubulin dekoriert sind, die meisten jedoch keine eindeutig interpretierbaren Hooks aufweisen. |
||||
Weiterhin fällt in vielen Schnitten, insbesondere in Abb. 7 auf, daß Filamente im Zellplasma liegen, die in normalen Einbettungen nicht in dieser Häufigkeit zu sehen sind. Diese Filamente sind stark mit Tannin kontrastiert und haben im Querschnitt einen Durchmesser von ca. 5 nm. Häufig findet man solche Filamente in 15 - 20 nm Abstand zu Mikrotubuli.
| Bündel Nr. | Mit Tubulin-Hooks dekorierte Mikrotubuli | % im Uhrzeigersinn | |
|---|---|---|---|
| gegen den Uhrzeigersinn | im Uhrzeigersinn | ||
| 1 | 3 | 4 | 57,14 |
| 2 | 1 | 5 | 83,33 |
| 3 | 4 | 16 | 80 |
| 4 | 7 | 27 | 79,41 |
| 5 | 2 | 0 | 0 |
| 6 | 2 | 2 | 50 |
| 7 | 0 | 4 | 100 |
| 8 | 0 | 0 | 0 |
| 9 | 0 | 1 | 100 |
| 10 | 1 | 1 | 50 |
| 11 | 3 | 3 | 50 |
| 12 | 4 | 5 | 55,56 |
| 13 | 2 | 8 | 80 |
| 14 | 4 | 1 | 20 |
| 15 | 0 | 4 | 100 |
| 16 | 0 | 2 | 100 |
| 17 | 0 | 6 | 100 |
| 18 | 1 | 5 | 83,33 |
| 19 | 1 | 1 | 50 |
| 20 | 0 | 3 | 100 |
| 21 | 0 | 0 | 0 |
| 22 | 0 | 2 | 100 |
| 23 | 2 | 0 | 0 |
| 24 | 0 | 6 | 100 |
| 25 | 19 | 39 | 67,24 |
| 26 | 3 | 3 | 50 |
| 27 | 1 | 2 | 66,67 |
| Summe | 60 | 150 | 71,43 |
Tabelle 8: Orientierung der Tubulin-Häkchen bei der "Hook-Dekoration" von Reticulomyxa-MTDie in den ausgewerteten Schnitten vorgefundenen MT-Bündel wurden willkürlich durchnumeriert und die vorhandenen MTs nach der Drehrichtung der Tubulin-Hooks klassifiziert. Die meisten Tubulin-Hooks sind bei Betrachtung von der Zellperipherie her im Uhrzeigersinn gedreht. |
|||
Von den MT, die interpretierbare Häkchen aufweisen, ist eine eindeutige Mehrheit von 71% bei Betrachtung von der Zellperipherie her im Uhrzeigersinn gedreht. Nach der "Rechte-Hand-Regel" (Heidemann & McIntosh, 1980) sind die minus-Enden der MT also zum Zellkörper hin orientiert.
6-DMAP
Der Protein-Kinase Inhibitor 6-DMAP wurde schon früh als potenter Mitoseinhibitor beschrieben (Rebhun et al., 1973). Die Zugabe von 6-DMAP bewirkt bei vielen Zellen eine Arretierung in der Metaphase. Da die Zugabe von 6-DMAP die Phosphorylierung von Proteinen um ca. 20% verringert (Moses et al., 1995), wird angenommen, daß 6-DMAP spezifisch Proteinkinasen inhibiert, welche die Umgestaltung von MTOCs im Verlauf des Zellzyklus beeinflussen (Kaczanowska et al., 1996).
Auf den Austausch des Mediums gegen solches das 300µM 6-DMAP enthält, reagiert das RPN von Reticulomyxa nur mit einem kurzfristig etwas verstärkten Rückstrom des Plasmas aus dem RPN zum Zellkörper hin. Auch der intrazelluläre Transport ist offenbar geringfügig beeinträchtigt; die Zellen erholen sich davon jedoch innerhalb kurzer Zeit (ca. 30 Minuten). Die Ausbildung von neuen feinen Ausläufern und die Refusion zufällig abgerissener Abschnitte des RPN verlaufen offenbar normal.
Nach einstündiger 6-DMAP-Behandlung scheinen die Zellen bei fluoreszenzmikroskopischer Beobachtung weniger MT als üblich zu besitzen. Die Verteilung der MT ist jedoch normal (Abb. 9; vergleiche dazu unbehandelte Cytoskelette, z.B.: Abb. 94 bis 99). Die Mikrotubuli scheinen intakt und von der Drogenbehandlung sonst unbeeinflußt zu sein. Das elektronenmikroskopische Bild bestätigt diesen Eindruck (Abb. 12).
Im Verlauf einer längeren Inkubation in 300 µM 6-DMAP nimmt die Vitalität der Zellen allmählich ab, das RPN wird abgebaut und die Plasmaströmung im Zellkörper verringert sich. Nach einer Inkubationsdauer von 16 bis 24 Stunden sterben die Zellen schließlich ab. Erstaunlicherweise sind jedoch Bereiche des RPN, die sich durch eine Verletzung oder Autotomie vom Zellkörper getrennt haben, in ihrer Vitalität nicht eingeschränkt und überleben den dazugehörigen Zellkörper um mehrere Stunden. Das Absterben der Zellkörper erfolgt auch innerhalb einer Kultur sonst gleich behandelter Zellen nicht synchron, sondern variiert bis zu mehreren Stunden.
Für die elektronenmikroskopischen Untersuchungen wurden einige noch lebende Organismen fixiert, sobald beobachtet werden konnte, daß die ersten ihrer Nachbarzellen im gleichen Versuchsansatz abstarben, um Aufschluß über die Ursache des Zelltodes zu erhalten. Abbildung 13 zeigt eine solche Zelle mit einem deutlich reduzierten MT-Cytoskelett, das auf relativ wenige MT beschränkt zu sein scheint. Größere MT-Bündel konnten nicht mehr gefunden werden. Dieser Eindruck wird auch durch die Immunfluoreszenz bestätigt (Abb. 10), denn auch hier zeigt sich eine deutlich verringerte Anzahl von MT, die sonst jedoch typisch verteilt sind. Auch die Struktur der Zellkerne ist normal und ohne offenkundige Veränderungen gegenüber dem Normalzustand.
Die massivsten Veränderungen nach längerer 6-DMAP-Behandlung erfährt die Verteilung der Zellorganellen: Während die Zellkerne weiterhin im Zellkörper liegen, ist das endoplasmatische Reticulum, und mit ihm zahlreiche Polysomen, die sonst streng auf den Zellkörper beschränkt sind, auch in den Ausläufern des RPN zu finden. Gelegentlich gewinnt man den Eindruck, daß das Lumen der ER-Schläuche auch angeschwollen oder gar deformiert sei.
Nach dem Absterben der Zellen sind kaum noch cytoplasmatische MT aufzufinden. Stattdessen sind in abgestorbenen Zellkörpern die Kernmembranen deutlich mit einem Anti-Tubulin mAK markierbar (Abb. 11). Der Verdacht, daß vielleicht Tubulin in den Zellkernen angereichert werden könnte, um eine Zellteilung vorzubereiten, ließ sich jedoch bei elektronenmikroskopischer Betrachtung der Zellkerne unter 6-DMAP-Einwirkung sterbender Zellen nicht bestätigen. Daher handelt es sich bei der Tubulin-Markierung der Zellkerne möglicherweise um ein Fixierungsartefakt.
Lokalisation von MTOCs
Den Plasmodien von Reticulomyxa filosa fehlt jede auffällige MTOC-Struktur; Centrosomen konnten bislang nicht gefunden werden, und auch die Ausbildung der mitotischen Spindel bei Teilungszellen erfolgt nicht über konventionelle MTOCs, sondern, da es sich um geschlossene Mitosen (Hülsmann, 1984) handelt, wohl von der inneren Kernmembran aus.
Verfolgt man jedoch den Verlauf von MT im Elektronenmikroskop, so findet man an ihren Enden regelmäßig torusförmige Strukturen von ca. 60 nm Durchmesser und 25 nm Dicke (Abb. 14 und 15). Im Querschnitt erscheinen diese Strukturen wie Ringe über die Enden der MT gesteckt zu sein. Besonders deutlich wird die Verbindung von MT-Enden und diesen Strukturen bei Zellen, die gerade viele MT (z.B. nach MgCl2-Behandlung) aus helikalen Filamenten aufbauen (Abb. 54 bis 56).
Fig. 5 Schemazeichnung eines typischen putativen MTOCsDie meisten beobachteten Mikrotubulus-Enden von Reticulomyxa sind von elektronendichten, kragenförmigen Strukturen umgeben. Diese haben einen Durchmesser von 60 nm und eine Dicke von ungefähr 25 nm. Das distale Ende der kragenförmigen MTOCs scheint offen zu sein. |
 |
Diese torus- oder kragenförmigen Strukturen bedecken anscheinend die Enden vieler, wenn nicht aller MT in Reticulomyxa filosa. Man findet sie zumeist an den distalen MT-Enden (Abb. 14), was aber auch daran liegen kann, daß diese Enden in den Präparaten leichter zu finden sind. In einigen Fällen sind jedoch auch in einem Präparat gegenläufige Enden benachbarter MT mit diesen kragenförmigen Strukturen bedeckt (Abb. 15), was darauf hindeutet, daß möglicherweise beide MT-Enden von solchen Strukturen eingefaßt werden. Wegen der großen Länge der MT in Reticulomyxa ist es leider nicht gelungen, beide Enden eines MT gleichzeitig zu beobachten, um diese Vermutung bestätigen zu können.
Der Antikörper CTR 210 ist gegen humane Centrosome gerichtet, markiert aber auch in Basalkörpern von Paramecium tetraurelia die den Basalkörper umgebende Substanz (Keryer et al., 1990). Markiert man das RPN von Reticulomyxa mit diesem Antikörper (Abb. 16 und 17), so erhält man in den Strängen des RPN und den Lamellipodien eine punktförmige Markierung, die nicht mit der Verteilung von im Phasenkontrastbild erkennbaren Zellorganellen übereinzustimmen scheint. Vielmehr gewinnt man den Eindruck, es handle sich um Strukturen, die eigentlich unter der Auflösungsgrenze von Lichtmikroskopen liegen und nur durch den Vergröberungseffekt der Fluoreszenzmarkierung sichtbar werden.
Eine vergleichbare Erscheinung entsteht auch bei der Inkubation mit einem Antikörper, der spezifisch gegen Reticulomyxa-g-Tubulin gerichtet ist (Kube-Granderath & Schliwa, 1996). Hier sieht man zwei verschiedene Fluoreszenzmuster. Eine diffuse Markierung, die das gesamte RPN durchgehend erkennt ist deutlich unterschieden von einer auf scharf umgrenzte Strukturen beschränkten punktförmigen Fluoreszenz (Abb. 18). Das Verteilungsmuster der punktförmigen Markierungen mit dem Anti- Reticulomyxa-g-Tubulin pAK entspricht in etwa dem mit dem mAK CTR 210 erzielten Ergebnis.
Centrin ist ein Bestandteil 3 - 8 nm dicker Filamente, die im pericentriolären Material vieler höherer Eukaryoten zu finden sind (Baron et al., 1992). Centrin ist auch in den MTOCs von Farnpflanzen, Paramecium, Algen und Hefen zu finden (Hoffman et al., 1994; Madeddu et al., 1996; Wiech et al., 1996). Der Antikörper gegen Spermatozopsis-Centrin (Lechtreck et al., 1989), der in dieser Arbeit eingesetzt wurde, markierte hingegen keine Strukturen im RPN von Reticulomyxa.
In anderen Versuchen wurden Zellen experimentell das zentrale Plasma und damit auch alle potentiellen zentralen MTOCs entfernt. Es verblieben nur einige faden- bis lamellipodienförmige Bereiche des Zellkörpers. Durch kurze Homogenisation mit der Pipette und anschließende Verdünnung wurde verhindert, daß diese Bruchstücke wieder miteinander fusionieren konnten. Dabei entstanden kleine, 20 bis 100 µm lange Bruchstücke, die im Idealfall nur aus einem einzigen fadenförmigen Pseudopodium bestanden (Abb. 20). Obwohl diese Bruchstücke keine Zellkerne und kaum lichtmikroskopisch erkennbare Organelle besitzen, zeigen sie noch über viele Stunden rege Formveränderungen, die mit der Erschöpfung der Energiereserven erst allmählich zum Erliegen kommen. Die Immunmarkierung mit dem mAK ID5 zeigt, daß die Zellfragmente dennoch über ein intaktes MT-Cytoskelett verfügen, das an den fortgesetzten Formveränderungen beteiligt sein muß (Abb. 19 und 20).
Heterologe Polymerisation von Mikrotubuli
Eine Möglichkeit, die Nucleationsorte von MT ausfindig zu machen, ist die Inkubation von Zellextrakten mit polymerisationsfähigem Tubulin und GTP. Auf diese Weise haben Mitchison und Kirschner (1984) z. B. die MT-nucleierende Fähigkeit von Centrosomen nachweisen können.
Analoge Versuche wurden deshalb auch an Reticulomyxa durchgeführt: Durch Inkubation mit isoliertem Hirntubulin unter polymerisationsfördernden Bedingungen wurde versucht, die MTs von lysierten Zellen durch Anpolymerisation zu verlängern bzw. neue MTs an deren putativen MTOCs zu bilden. Neugebildete heterologe MTs wurden mit dem mAK YL 1/2 nachgewiesen, der nicht mit Reticulomyxa-Tubulin (siehe den Abschnitt über Tubulin-Isotypen; Hauser et al., 1989), wohl aber mit Hirntubulin reagiert.
Tatsächlich zeigen sich bei hohen Tubulin-Konzentrationen (1,4 mg/ml Tubulinextrakt) zahlreiche neugebildete MTs. In dicken Plasmasträngen des RPN (Abb. 21) sind neben vielen kleinen, granulären Gebilden auch lineare Strukturen zu erkennen.
Deutlicher wird die Neubildung von MT in Abb. 22, wo an vielen Stellen deutlich lineare Strukturen zu erkennen sind. Außer den MTs, die direkt mit dem RPN von Reticulomyxa in Verbindung stehen, sind zahlreiche freie MT zu erkennen, die durch unabhängige Polymerisation entstanden sind.
Bei niedrigeren Tubulin-Konzentrationen (Abb. 23: 1 mg/ml Tubulin und Abb. 24: 0,5 mg/ml Tubulin) nimmt nicht nur die freie Polymerisation von Tubulin ab, sondern gleichzeitig verschwinden auch die neu gebildeten MT in den Reticulopodien. Die verbleibende Fluoreszenz ist diffus und vermutlich an membranöse Organelle gebunden.
Beeinflussung des MT-Polymerisationsverhaltens
Viele Faktoren beeinflussen das Reaktionsgleichgewicht zwischen freiem Tubulin und den Mikrotubuli. Kälte (Wallin & Stromberg, 1995) oder Calcium-Ionen (Stromberg & Wallin, 1994), sowie eine Fülle von Naturstoffen unterschiedlichster Herkunft (Review in Hamel, 1996) interagieren mit freien Heterodimeren oder den MT und beeinflussen die Polymerisation.
Bei Reticulomyxa kommen in vivo außer den MT noch eine weitere Aggregationsform des Tubulins hinzu, die helikalen Filamente, denen ähnlich wie bei Allogromia (Hauser & Schwab, 1974; Golz & Hauser, 1986) eine Intermediatrolle zugeschrieben wird. Daher stellt sich die interessante Frage, ob und welchen Einfluß Agenzien, die bei anderen Organismen in das Gleichgewicht zwischen MT und Tubulin eingreifen, auf den Abbau von MT zu HF oder Tubulin haben, und ob es darüber hinaus auch Substanzen gibt, die bei anderen Organismen wirkungslos sind, bei Reticulomyxa jedoch auf das Gleichgewicht zwischen MT und HF einwirken.
Kältebehandlung
Abkühlung auf 0-40C bewirkt bei den meisten MT-Systemen eine nach Zelltyp unterschiedlich schnelle Depolymerisation. Auch bei Reticulomyxa fand Froese (1990), daß Kälte innerhalb weniger Minuten zum Stop des Organellentransports führt, und daß sich nach mehrtägiger Inkubation bei 40C in den Zellen ein erhöhter Anteil von helikalen Filamenten und Parakristallen befindet.
Im Rahmen der vorliegenden Arbeit ließen sich die Beobachtungen von Froese (1990) bestätigen. Die Abkühlung der Zellen führt zum Erliegen des bidirektionalen Transports und zum allmählichen Abbau des RPN. Obwohl kein bidirektionaler MT-gebundener Transport mehr beobachtet werden konnte, sind zu jedem Zeitpunkt der Abkühlung noch MT in Koexistenz mit helikalen Filamenten vorhanden. (Abb. 25) Im Verlauf der mehrtägigen Kälteinkubation wird das RPN bis auf kurze besenförmige Fortsätze des Zellkörpers zurückgebaut.
Die Reste des RPN und der Zellkörper selbst enthalten stets neben einer erhöhten Menge helikaler Filamente immer noch zahlreiche MT (Abb. 26 und 27: einen Tag Kälte; Abb. 29 und 30 Inset: drei Tage Kälte). Im Verlauf der mehrtägigen Kälteinkubation nehmen Anzahl und Packungsgrad der helikalen Filamente zu (Abb. 25: sechs Stunden Kälte; Abb. 28: einen Tag Kälte; Abb. 30: drei Tage Kälte).
Um den Mechanismus des MT-Abbaus genauer zu untersuchen, wurden die Zellen in einem in-vitro Experiment erst lysiert und dann für 10 Minuten auf einen eisgekühlten Metallblock aufgelegt. Das RPN dieser Zellen überstand die Kälteinkubation bei der gewählten Inkubationsdauer ohne Formveränderung und enthielt im elektronenmikroskopischen Bild auch zumeist zahlreiche MT (Abb. 32). Eine Ausnahme zeigt Abb.33, wo ein Pseudopodium nach der Kälteinkubation außergewöhnlich viele helikale Filamente enthält.
Das RPN von Kontrollzellen, die nach gleicher Lysis bei Raumtemperatur weiter inkubiert wurden, ist durch die stärkere Dissoziation der Zellmembran und der Organellen von den MT stärker gegenüber kältebehandelten Zellen verändert (Abb. 31). Die MT der Kontrollzellen sind durch die Behandlung nicht beschädigt worden und die Häufigkeit helikaler Filamente ist normal.
Calcium-Inkubation
Schon 1,5 mM Ca2+ verhindern die Polymerisation von Tubulin zu MT (Weisenberg, 1973; Stromberg & Wallin, 1994). Durch Mikroinjektion geringer Volumen einer 1 mM CaCl2-Lösung in mitotische Zellen gelang es Kiehart (1981), die MT der Teilungsspindel abzubauen. Welche Wirkung Ca2+ auf das Cytoskelett von Reticulomyxa hat, wurde an Zellmodellen untersucht. Dabei wurden Zellen durch Lysis in Lysismedium VIII permeabilisiert und dann in Puffer mit 2 mM CaCl2 für eine variable Zeitspanne (1 - 10 Minuten) inkubiert.
Im Vergleich zu den Kontrollzellen, die nach der Lysis für die gleiche Zeitdauer in Calcium-freiem Puffer gelagert waren (Abb. 35) zeigt das RPN von Calcium-behandelten Zellen (Abb. 34) keine auffälligen Veränderungen. Die Mikrotubuli der Organismen wurden mit dem mAK ID5 markiert und zeigen sowohl bei den behandelten (Abb. 34), als auch bei den Kontrollzellen (Abb. 35) eine durchgehende Verteilung ohne Abbautendenzen erkennen zu lassen.
Bei Flagellaten der Art Entosiphon sulcatum, die gelegentlich in den Reticulomyxa-Präparaten als Verunreinigung zu finden sind, führt die gleiche Behandlung schon nach fünf Minuten Inkubation in Ca2+-haltigem Puffer zum Abbau von Flagellen- und Pellicula-MT, und nach zehnminütiger Inkubation werden auch die stabilisierten MT des Siphons abgebaut (Mütze et al., 1996). Daher ist es umso erstaunlicher, daß die MT von Reticulomyxa die Behandlung anscheinend schadlos überstehen.
Lanthan
Das Lanthan-Ion La3+ ist als Inhibitor von zellmembranständigen Ca2+-Kanälen und -Pumpen bekannt (Morley & Whitfield, 1993; Hepler, 1992) und blockiert den gesamten Ca2+-Transport durch die Plasmamembran. Auch viele andere Zelloberflächenkomponenten werden von Lanthan blockiert (Baker, 1986). Da die Freisetzung von Calcium nicht nur in vitro die Polymerisation von Tubulin verhindert (Weisenberg, 1973), sondern auch den intrazellulären MT-Umbau, z.B. in der Mitose (Hepler, 1992) steuert, ist die Wirkung von Calcium-Antagonisten auf die Cytoskelettorganisation von Reticulomyxa von besonderem Interesse.
Es zeigt sich, daß schon geringe La3+-Konzentrationen die Organisation des RPN von Reticulomyxa verändern. 1 mM La3+ im Kulturmedium führen zum augenblicklichen Arrest aller zellulärer Bewegungsvorgänge. Neue Pseudopodien werden nicht mehr ausgebildet und der Partikeltransport kommt zum Erliegen. Die kleinen Körnchen im Cytoplasma bleiben nicht an MT gebunden, sondern vollführen nur noch ungeordnete Brown'sche Molekularbewegung, wie man in Verzweigungen und Lamellipodien sehen kann. Nach 10-minütiger Inkubation zieht sich das Plasma allmählich an den Verzweigungpunkten des RPN zu Knoten zusammen. Die kontraktilen Vakuolen in den Plasmaansammlungen werden nicht mehr entleert und vergrößern sich allmählich bis zum Platzen. Dieser Effekt ist von längeren DNP-Inkubationen her bekannt (Froese, 1990) und deutet darauf hin, daß der gesamte Energiestoffwechsel der Zelle zusammengebrochen ist.
Um beurteilen zu können, ob die Wirkung von Lanthanchlorid auf einer Verschiebung des pH beruht, wurde dieser vor und nach der Lösung von 1 mM LaCl3 gemessen. Es trat eine pH-Verschiebung von 7,2 auf 7.0 auf. Diese pH-Änderung liegt jedoch innerhalb der Toleranzbreite des Kulturmediums selbst (s. S. 13), so daß von ihr keine Wirkung auf die Zellen zu erwarten ist.
Werden die Zellen länger als eine Minute in 1 mM Lanthanchlorid inkubiert, tritt eine irreversible Schädigung ein; bei sehr kurzen Inkubationszeiten können Teile des RPN wieder regenerieren.
Die gleiche Wirkung hat 0,5 mM LaCl3, mit dem einzigen Unterschied, daß nach 1-minütiger Inkubation größere Plasmaabschnitte noch zur Regeneration fähig sind (Abb. 36a bis f). Interessanterweise sind die ersten Pseudopodien, die der Zellkörper bildet, ungefähr 10-mal so dick wie gewöhnlich (Abb. 36c und 37); dieser Effekt hebt sich aber nach wenigen Minuten wieder auf. Die später gebildeten Pseudopodien enthalten außergewöhnlich viele kleine Vakuolen, was besonders beim Vergleich der Bilder 36a und 36f auffällt.
Die Grenzkonzentration für die Wirkung von La3+ liegt bei 0,2 mM. Bei dieser Konzentration treten die vorgenannten Effekte wie Erstarrung des Umbaus des RPN, Stop des Körnchentransportes, Vergrößerung der Vakuolen und allmähliches Zusammenziehen des Plasmas zu Perlschnüren noch auf, aber der Vorgang ist auch nach zehnminütiger Inkubation noch reversibel. Ungewöhnlich dicke Pseudopodien, wie bei 0,5 mM treten bei der Regeneration nur noch gelegentlich auf.
Die ultrastrukturelle Untersuchung zeigt, daß die Inkubation mit Lanthanchlorid nicht primär das MT-Cytoskelett beeinflußt. Zellen, die in 0,25 mM LaCl3 für fünf Minuten inkubiert wurden, zeigen im Elektronenmikroskop ein normales Cytoskelett (Abb. 39), das nicht außergewöhnlich reich an helikalen Filamenten ist. Die Oberfläche der meisten Zellausläufer bildet zahlreiche unregelmäßig geformte Anhänge aus (Abb. 38), die in unbehandelten Zellen nicht zu finden sind. Möglicherweise handelt es sich dabei um Elemente der Glycokalyx, die durch das Schwermetall deutlicher kontrastiert wurden.
Nocodazol
Das Benzimidazolderivat Nocodazol ist dafür bekannt, daß es schon in mikromolaren Konzentrationen MT in Pflanzenzellen (Raudaskoski et al., 1994; Rupes et al., 1995) und in einer Vielzahl von tierischen Zellen (Jordan et al., 1992; Takemura et al., 1995) reversibel abbaut. Verschiedene Autoren fanden jedoch in vivo (Koonce et al., 1986) und in vitro an lysierten Zellmodellen (Koonce & Schliwa, 1986) keinen Nocodazol-induzierten MT-abbau im RPN von Reticulomyxa.
Diese Beobachtungen wurden in der vorliegenden Arbeit durch in-vitro Versuche vertieft, bei denen im Gegensatz zu dem Ansatz von (Koonce & Schliwa, 1986) Lysismedien ohne MT-stabilisierende Zusätze verwendet wurden.
Nach Lysis in PHEM-Puffer + 0,15% Brij und anschließender 10-minütiger Inkubation in 10µM Nocodazol zeigen sich in der Tubulin-Markierung (Abb. 40) keine Abbauerscheinungen an den MT. Durch die Lysis in einem nicht MT-stabilisierenden Medium ohne Vanadat und die Turbulenzen beim Austausch des Medium haben sich die einzelnen MT aus dem Verbund gelöst und liegen ausgebreitet wie ein feiner Schleier neben den Pseudopodien. Bei der Menge vorhandener MT kann ein - auch partieller - Abbau jedoch ausgeschlossen werden.
MgCl2
Bis vor kurzem wurde der Konzentration von Mg2+-Ionen in der Zellphysiologie keine besondere Bedeutung beigemessen. Es wurde angenommen, daß die intrazelluläre Mg2+-Konzentration um 30 mM läge (Preston & Kung, 1994b). Erst neuere Untersuchungen (Alvarez-Leefmans et al., 1987) zeigten, daß die Mg2+-Konzentration in den Zellen künstlich niedrig gehalten wird (< 1 mM), wofür ein spezieller Magnesium-Carrier verantwortlich gemacht wird. In den vergangenen Jahren wurden Mg2+-leitende Membrankanäle (Preston & Kung, 1994b) und sogar Mg2+-konzentrationsabhängige Verhaltensmutanten bei Paramecium (Preston & Kung, 1994a) gefunden.
Daß 20 mM MgCl2 bei Reticulomyxa zum Stop des intrazellulären Transports führen, erwähnten schon Koonce et al. (1986), mögliche Ursachen dafür wurden jedoch nicht angegeben.
Lichtmikroskopische Untersuchungen der Reaktion des RPN auf verschiedene MgCl2-Konzentrationen ergaben folgendes:
Bei 100 mM (Abb. 41) und 50 mM MgCl2 kommt die Körnchenströmung im RPN innerhalb von 30 Sekunden zum Erliegen. Das Plasma zieht sich allmählich perlschnurartig zusammen. Wenn nach 10-minütiger Inkubation das Medium wieder ausgewaschen wird, kann die Zelle nicht wieder regenerieren.
30 mM MgCl2 führen ebenfalls zum allmählichen Stop der Körnchenströmung, allerdings verlangsamt sie sich nur in den dünnen Bereichen des RPN innerhalb von 30 Sekunden; dickere Abschnitte des RPN brauchen deutlich länger bis in ihnen kein Transport mehr stattfindet. Die dicken Adern des Zellkörpers bleiben über längere Zeit unbeeinträchtigt. Wird die Salzlösung nach 10 Minuten wieder ausgewaschen, kann das RPN nicht mehr regenerieren, aber der Zellkörper ist noch in der Lage, neue Pseudopodien zu bilden.
20 mM MgCl2 inhibieren ebenfalls innerhalb von 30 Sekunden die Körnchenströmung, verändert aber das RPN ansonsten kaum. Die dickeren Abschnitte des RPN brauchen ungefähr fünf Minuten bis zum Bewegungsstop. Nach zehn Minuten Inkubation kann die Salzlösung wieder ausgewaschen werden und der intrazelluläre Transport wird innerhalb von fünf Minuten wieder aufgenommen.
15 mM MgCl2 führen nur noch allmählich innerhalb von fünf Minuten zum Bewegungsstop im RPN. Nach zehn Minuten Inkubationsdauer beginnt die Körnchenströmung teilweise von selbst wieder.
Bei geringeren MgCl2-Konzentrationen kommt es nur noch kurzfristig zu Bewegungsstops in einzelnen Abschnitten des RPN, die sich selbsttätig wieder zurückbilden. Ab 7,5 mM MgCl2 ist kein Effekt mehr nachweisbar.
In der Immunfluoreszenz wird die Wirkung von 20 mM Magnesium auf das MT-Cytoskelett von Reticulomyxa deutlicher. Abb. 43 zeigt Zellen, die eine Minute lang mit 20 mM MgCl2 behandelt worden sind. Während das RPN im Phasenkontrast keinen Unterschied zur unbehandelten Kontrollzelle (Abb. 42) zeigt, beweist die Markierung mit dem AK ID5, daß die Mikrotubulibündel nicht mehr durchgehend sind, sondern in kürzere, gebogene Aggregate zerfallen sind (Abb. 43). Noch deutlicher wird dieser Eindruck nach fünfminütiger MgCl2-Behandlung (Abb. 45).
Im Elektronenmikroskop erkennt man bei Magnesiumchlorid-behandelten Zellen, daß in den Ausläufern des RPN die Anzahl der HF deutlich zugenommen hat. Bei 100 mM MgCl2 und 5-minütiger Inkubationsdauer sind quasi alle MT in HF umgewandelt (Abb. 48), wobei letztere zumeist schon in dichtgepackten Tubulin-Parakristallen vorliegen. Tubulin-Parakristalle sind von der Foraminifere Allogromia her bekannt; bei Reticulomyxa kommen sie außer nach MgCl2-Behandlung nur bei den dünnwandigen Ruhestadien (s. S. 47) vor. Gelegentlich sind dichte Aggregate von Tubulin-Parakristallen auch im Fluoreszenzmikroskop erkennbar (Abb. 44).
Nach Einsatz von 20 mM Magnesiumchlorid kann der Effekt auf die Mikrotubuli besonders gut im Elektronenmikroskop beobachtet werden. Nach einminütiger Behandlung (Abb. 49 bis 51) sind nur wenige Mikrotubuli in HF umgewandelt. In dickeren Pseudopodien (Abb. 49) ist zu erkennen, daß die peripheren MT eines Bündels bereits in HF umgewandelt sind, während die zentralen MT noch ihre ursprüngliche Struktur behalten haben. Je nach den lokalen Gegebenheiten kann die Umwandlung in den Pseudopodien mehr oder weniger weit fortgeschritten sein.
Die Abbildungen 50 und 51 zeigen Pseudopodien mit ersten Anzeichen der Magnesium-Behandlung: Nahe der Plasmamembran sind teilweise schon helikale Filamente zu sehen, während die zentralen MT noch unbeeinflußt sind. Dazwischen, im membrannahen Bereich, finden sich häufig MT, die eine mehr oder weniger deutliche Schrägstreifung aufweisen.
Nach fünfminütiger Inkubation in 20 mM MgCl2 hat sich ein Großteil der MT in helikale Filamente umgewandelt (Abb. 52). Nur die zentralen MT in einzelnen Bündeln sind noch erhalten. In den Detailansichten erkennt man (Abb. 54), daß je nach Lage - und wahrscheinlich auch den lokalen Gegebenheiten beim Austausch der Inkubationsmedien - bis zu 50 % der MT noch nicht in helikale Filamente umgewandelt worden sind.
Wird das 20 mM Magnesiumchlorid wieder ausgewaschen, kann man schon nach zwei Minuten in der IIF mit dem mAK ID5 neben den immer noch vorhandenen gebogenen Tubulinaggregaten wieder feine lineare Strukturen erkennen, die wahrscheinlich neu gebildete MT darstellen (Abb. 47). Zu diesem Zeitpunkt sind auch im Elektronenmikroskop neben immer noch zahlreichen HF eine ganze Reihe neu gebildeter MT sichtbar (Abb. 54), die wahrscheinlich die Ursache für die lichtmikroskopisch sichtbare Regeneration der Körnchenströmung sind.
Die dabei neugebildeten MT sind oft von relativ geringer Länge, so daß man häufig Endbereiche findet, an denen die typischen kragenförmigen Strukturen, die vermutlich MTOCs darstellen, zu sehen sind. Abbildung 15 stammt von solchen nach MgCl2-Behandlung regenerierenden Zellen, und die Abbildungen 55 und 56 zeigen weitere Beispiele für diese Strukturen. In einigen Plasmaarealen finden sich größere Ansammlungen elektronendichter Scheiben, die wahrscheinlich die gleichen Strukturen, diesmal jedoch ohne Bindung an MT darstellen (Abb. 53).
Um zu untersuchen, ob für die Umwandlung von MT in HF Energie benötigt wird, wurden die Zellen vor Applikation von 20 mM MgCl2 mit DNP inkubiert. Diese Substanz wurde bereits 1948 von Loomis und Lipmann als Entkoppler der oxidativen Phosphorylierung beschrieben. Die Entkopplung bewirkt einen ATP-Mangelzustand in der Zelle.
Wie Froese (1990) beobachten konnte, führen bereits 0,3 mM DNP innerhalb von fünf Minuten zur deutlichen Verlangsamung des bidirektionalen Transports in Reticulomyxa. In den hier vorgestellten Versuchen wurden die Zellen mit 1 mM DNP bis zum vollständigen Bewegungsstop, der zumeist innerhalb von fünf Minuten auftrat, inkubiert. Danach wurden die Zellen für eine Minute mit 20 mM Magnesiumchlorid behandelt und mit dem Anti-Tubulin AK ID5 markiert.
In der Immunfluoreszenz sind nur noch wenige durchgehende MT Bündel zu erkennen (Abb. 46). Der Großteil des Tubulins liegt in unregelmäßig geformten Aggregaten vor.
In weiteren Versuchen wurden die Zellen vor der Applikation von 20 mM MgCl2 einer kurzen Lysisbehandlung unterworfen und für die Betrachtung im Elektronenmikroskop eingebettet. In den Ultradünnschnitten dieser Zellen waren nur noch wenige MT zu finden (ohne Abbildungen), auch deutliche helikale Filamente waren nicht zu erkennen. Es fiel jedoch auf, daß in den Pseudopodien des RPN außergewöhnlich viele 5-nm-Filamente gefunden werden können.
Erstaunlicherweise zeigte sich in weiteren Versuchen, daß auch andere Salze in höheren Konzentrationen einen Effekt auf den Transport im RPN haben. Sowohl 30mM LiCl, als auch MgSO4, NaCl, KCl und Glucose in gleicher Konzentration führen bei lichtmikroskopischen Beobachtungen zum Bewegungsstop. Im Elektronenmikroskop bestätigte sich dieser Eindruck; zumindest bei höheren (100 mM) Salzkonzentrationen sind zahlreiche MT in HF umgewandelt worden.
Taxol
Das Diterpen Taxol wurde von Monroe Wall et al. (1971) als hochpotente Antitumordroge entdeckt (Wani et al., 1971). Es wirkt antimitotisch durch die Stabilisierung von MT bzw. durch Erhöhung der Polymerisationsrate von Tubulin (Schiff et al., 1979). Heutzutage dient Taxol als Ausgangsstoff für die Synthese zahlreicher künstlicher Derivate, die ebenfalls in der Chemotherapie eingesetzt werden sollen (Arbuck et al., 1993).
Anders als bei Allogromia (Golz, 1986) beobachtet, konnte lichtmikroskopisch kein Effekt von 10 µM Taxol auf die Ausbildung des RPN nachgewiesen werden. Einige Zellen wurde in Deckglaskammern verbracht, in denen sie für mehrere Stunden Gelegenheit erhielten, ein RPN auszubilden. Dann wurde das Medium bei der Hälfte der Zellen gegen solches mit 10 µM Taxol ausgetauscht. Auch nach dreitägiger Inkubation ließ sich kein Unterschied zwischen den Wuchsbildern behandelter und unbehandelter Zellen finden (ohne Abbildungen). Wurden die Zellen danach für weitere drei Tage in die Kälte verbracht, bildete sich bei behandelten wie unbehandelten Zellen das RPN zurück, ohne daß ein Unterschied zur Kontrolle erkennbar wurde.
Weiterhin wurde versucht, die Experimente von Hauser et al. (1989) nachzuvollziehen, in denen nach längeren Taxolinkubationen im RPN von Reticulomyxa mit dem mAK YL 1/2 markierbares tyrosiniertes Tubulin aufgetreten war. Dies gelang jedoch nicht. (Vgl. dazu die Ergebnisse der IIF.)
Das elektronenmikroskopische Bild von mehrere Tage mit 10 µM Taxol behandelten Zellen weist jedoch einige Unterschiede zu Kontrollen auf. Das Plasma wirkt etwas aufgelockert; ein Effekt, der wahrscheinlich auf das zur Lösung des Taxols eingesetzte DMSO zurückzuführen ist. Außerdem findet man in Quer- (Abb. 58) und insbesondere in Längsschnitten (Abb. 57) gehäuft langgestreckte Filamente. Helikale Filamente sind hingegen bei Taxol-behandelten Zellen nie zu finden.
Um zu testen, ob Taxol die MT von Reticulomyxa gegen die Bildung von helikalen Filamenten stabilisiert, wurden in einer Versuchsreihe die Zellen zuerst für einen Tag in 10 µM Taxol gehalten, und dann wurde die Bildung von helikalen Filamenten mit 20 mM MgCl2 induziert. Erstaunlicherweise zeigten sich die Zellen weiterhin gegen die Applikation von Magnesiumchlorid sensitiv. Die Körnchenströmung im RPN kam innerhalb weniger Minuten zum Erliegen.
Im elektronenmikroskopischen Bild zeigten die Zellen nur in wenigen Reticulopodien Strukturen, die eindeutig an HF erinnerten (Abb. 59). In den meisten Schnitten fand sich neben einer signifikant verringerten Anzahl von MT eine Anhäufung eher verklumpt wirkender Aggregate mit entfernt an HF erinnernder Struktur.
Die Arretierung des Körnchentransportes durch 20 mM MgCl2 ist auch bei Taxol-inkubierten Zellen innerhalb von 10 Minuten voll reversibel. Das Fehlen von helikalen Filamenten hat also nicht zu einer Arretierung in diesem Aggregationszustand geführt.
Actinverteilung und Anheftungsstellen in Reticulomyxa
Bei amöboid beweglichen Zellen lassen sich zwei verschiedene Schemata der Actinorganisation unterscheiden. Während Amoeba proteus mit Hilfe eines Actinlayers im Zellkortex (Hauser, 1978; Yanai et al., 1996) hydrostatischen Druck erzeugen, der das Endoplasma in die neu entstehenden Pseudopodien preßt, bilden sich die Pseudopodien von Leukocyten (Skalak et al., 1993), Fibroblasten (Liao et al., 1995), Dictyostelium (Jay et al., 1995), und an den Wachstumskegeln von Nervenzellen (Mitchison & Kirschner, 1988) durch die lokale Polymerisation von Actinfilamenten (Condeelis, 1992). In der vorliegenden Arbeit wurde die Verteilung von Actin in den Zellen von Reticulomyxa filosa genauer untersucht, um Aussagen über eine mögliche Beteiligung von Actin an den zellulären Bewegungsvorgängen machen zu können.
Actinorganisation im RPN von Reticulomyxa filosa
Wie im Methodenteil bereits erwähnt (vgl. Methodenteil) können die Protokolle verschiedener Autoren teilweise mit nur mit geringem Erfolg zur Darstellung der verschiedenen Organisationsformen filamentösen Actins in Reticulomyxa eingesetzt werden. Die in dieser Arbeit zumeist verwendete Actin-Darstellung zeigt eine sehr differenzierte Verteilung von Actinfilamenten, erhält aber die MT nur schlecht, so daß keine Doppelmarkierung von Actin und MT durchgeführt werden konnte.
Auch die Doppelmarkierungen nach den Methoden von Lindenblatt (1988) oder Koonce et al. (1986) wurden ausgetestet, erhielten aber die Actinfilamente nur schlecht. So ergibt die Doppelmarkierung nach Koonce et al. (1986) (Abb. 66) zwar ein typisches Bild der Mikrotubuli-Verteilung (Abb. 66a), stellt aber die Verteilung von Actinfilamenten nur unzureichend dar (Abb. 66b).
Im RPN von Reticulomyxa filosa läßt sich in fast allen Bereichen nach Fixierung mit Spermidin mit Hilfe von Rhodamin-Phalloidin F-Actin nachweisen. Folgende Strukturen sind unterscheidbar:
- In den feinen Strängen des RPN sind stets einige Actinfilamente (Abb. 60 und 61) zu finden, die parallel zu den MT verlaufen.
- Die Bereiche wenige µm unterhalb der Spitzen feiner RPN-Stränge (Abb. 62) enthalten deutlich mehr Actin, als der Rest des Strangs.
- Ebenso erkennt man in Bild 60, daß die Abzweigungen, an denen sich neue Stränge des RPN bilden, mit zusätzlichen Actinfilamenten verstärkt sind.
- Die hauchdünnen segelförmig abgeflachten Bereiche des RPN, die Lamellipodien, zeigen ein äußerst filigranes, feinverzweigtes Netzwerk an Actinfilamenten, das die ganze Fläche der Lamellipodien ausspannt (Abb. 61). Der Vergleich mit einer Tubulin-Markierung, z.B. in Abb. 42, zeigt, daß die Actinorganisation in den Lamellipodien nicht dem Verlauf der MT folgt.
- Ebenfalls an Lamellipodien findet man feine Säume aus unzähligen nach außen weisenden Actinfilamenten, die so dünn sind, daß sie im Phasenkontrast kaum zu erkennen sind (Abb. 61 und 63). Gelegentlich wachsen von hier auch kleine Filopodien aus. Diese abgeflachten Randbereiche der Lamellipodien sind sehr dünn und meist MT-los und daher in Präparaten, die mit Anti-Tubulin Antikörpern behandelt wurden nicht oder nur schwer zu erkennen.
- In elektronenmikroskopischen Präparaten von dem Randbereich von Lamellipodien findet man häufig ein dichtes Geflecht filamentöser Proteine, jedoch keine MT. Deutlich erkennt man in Abb. 65, daß einzelne Filamente direkt in der Spitze der Lamellipodien inserieren. Im Gegensatz zu den lamellipodialen Bereichen von Gewebekulturzellen fällt auf, wie wenig Kontaktstellen zum Substrat bestehen. Das Lamellipodium schwebt weitestgehend über dem Untergrund und ist nur an wenigen Stellen mit dem extrazellulären Substrat lose verbunden.
- An den Übergängen zwischen größeren Plasmamassen und dem RPN findet man in der Actinmarkierung stets 5 - 10 µM lange, wurzelförmig ausgebildete Actinaggregate (Abb. 64), deren aufgefächerte Seite an den Plasmamassen inseriert, während das spitze Ende in die Stränge des RPN zeigt. Typische Stellen, an denen diese Aggregate gefunden werden, sind Plasmabereiche, die sich infolge von Verletzungen zusammenziehen oder die Übergänge zwischen Lamellipodien und den Strängen des RPN. Diese Actinaggregate erinnern entfernt an die Stressfasern vieler Gewebekulturzellen, erscheinen aber kürzer und weniger differenziert ausgebildet zu sein. Besondere Zellorganellen, an denen die stumpfen Enden der Actinwurzeln inserieren, sind im Phasenkontrast nicht zu erkennen, möglicherweise gehen die stumpfen Enden in ein breit gefächertes Actinfilamentnetz über.
- Nicht zu den bisher beschriebenen Strukturen zu gehören scheinen kleine actinhaltige Flecken von wenigen Mikrometern Durchmesser, die insbesondere in vielen Lamellipodien zu finden sind. (Vgl. Abb. 61.)
Zelladhäsion und beteiligte Cytoskelettelemente
Bei schräger Auflichtbeleuchtung wird das Licht an den Grenzflächen durchsichtiger Objekte teilweise reflektiert. Aus den Reflexionserscheinungen gewinnt man Informationen über das Anheftungsverhalten von Zellen am Substrat. Zu der unterschiedlichen Helligkeit der Strukturen kommt es, weil das Licht an Grenzflächen mit verschiedenen Brechungsindices verschieden stark reflektiert wird. An Berührungsstellen mit dem Substrat (Glas) treten sehr schwache Reflexe auf, während diejenigen Zellbestandteile, die vom Substrat weiter entfernt sind, hell aufleuchten (Bereiter-Hahn & Vesely, 1994).
Bei geringen Unterschieden der Reflexionserscheinungen sind diese außerordentlich lichtschwach und können nur mit kontraststeigernden Maßnahmen sichtbar gemacht werden. Bevor das Licht auf das Objekt trifft, muß es einen Polarisator passieren. Im Abbildungsstrahlengang befindet sich ein Analysator, der zum Polarisator gekreuzt eingestellt ist, so daß kein Licht auf direktem Wege in das Auge des Betrachters gelangen kann. Damit das reflektierte Licht wahrgenommen werden kann, befindet sich ein l/4-Plättchen im Objektiv, das die Lichtwellen auf dem Hinweg und das reflektierte Licht auf dem Rückweg jeweils um l/4, zusammen also um l/2 verschiebt. Das um l/2 verschobene reflektierte Licht kann den Analysator passieren.
Die Lamellipodien von Reticulomyxa zeigen ein komplexes Muster an Substratkontakten, wie man in Bild 67a erkennen kann. Am beeindruckendsten ist eigentlich, wie gering die Fläche von Anheftungspunkten ist. Der Großteil des Lamellipodiums befindet sich in einigem Abstand vom Untergrund und berührt diesen nicht. Einige Ränder der Lamellipodien (z.B. in Abb. 68a) haben einen sehr feinen dunklen Saum, der darauf hindeutet, daß hier eine Kontaktstelle zum Untergrund besteht.
In der Fläche des Lamellipodiums verteilt findet man weitere Kontaktstellen, die zumeist unregelmäßig rundlich (Bild 67a) bis deutlich wurzelförmig (Abb. 70a) sind. Außerdem findet man manchmal kreisrunde Punkte, die von konzentrischen Ringen umgeben sind; dabei handelt es sich um die Abdrücke von Vakuolen, die durch das RPN transportiert und auf den Untergrund gedrückt werden.
An den Rändern des Lamellipodiums in Abb. 67a findet man zwei Bereiche, in denen gehäuft Substratkontakte vorkommen, möglicherweise handelt es sich hierbei um Überreste eines größeren, bereits zurückgebildeten Lamellipodiums, von dem nur noch die Anheftungsstellen verblieben sind.
Der Vergleich mit den korrespondierenden Bildern von der Actinverteilung in den Lamellipodien (Abb. 67b und 68b) zeigt, daß einige, aber nicht alle der unregelmäßig geformten oder wurzelförmigen Substratkontakte größere Mengen Actin enthalten. Die dunklen Säume, die manche Bereiche des Lamellipodiums umgeben, sind in der Actinmarkierung deutlich als Leitsäume aus gerichteten Actinfilamenten zu erkennen. In den meisten Bildern von rhodaminmarkierten Zellen (z.B. Abb. 68b) sind die Leitsäume in der Actinmarkierung jedoch schlecht zu erkennen, weil sie sich leicht vom Deckglas lösen. Das deutet darauf hin, daß die Leitsäume der Lamellipodien zwar den Untergrund berühren, aber nicht fest an ihm verankert sind.
In den Bereichen des RPN, die keine großflächigen Lamellipodien enthalten, (Abb. 69 - 71) sind ebenfalls nur spärlich Kontakte mit dem Substrat zu finden, und die meisten davon gehen sicherlich auf aufliegende Plasmastränge zurück, die keine spezifische Substratbindung ausgebildet haben. Einige dieser Kontaktstellen korrelieren jedoch mit Actin-Anhäufungen, so daß von einer actin-vermittelten Substratanheftung ausgegangen werden kann.
Nicht alle festen Verbindungen zum Deckglas sind jedoch durch Actinfilamente stabilisiert. Bild 72a zeigt den Rand eines großen Lamellipodiums, von dem zahlreiche Fortsätze ausstrahlen, deren Enden fest mit dem Substrat verbunden zu sein scheinen. Die Verteilung der Actinfilamente in diesem Bereich zeigt jedoch keine korrespondierende Verteilung; sie scheinen nicht direkt zu den Anheftungsstellen zu ziehen oder dort zu inserieren.
Es wurde versucht, mit einem kommerziellen Anti-Vinculin mAK (Sigma, Deisenhofen), mögliche Verknüpfungen zwischen Zellmembran und Actinfilamenten nachzuweisen. Der Antikörper war jedoch nicht in der Lage, bei Reticulomyxa Vinculin zu lokalisieren (ohne Abbildung). Daher ist nicht auszuschließen, daß die Substratanheftung bei Reticulomyxa über andere, möglicherweise bisher noch unbekannte, Proteine erfolgen könnte.
Cystenbildung
[EM-Bilder] Schon Ruth N. Nauss, die Erstbeschreiberin von Reticulomyxa filosa (Nauss, 1949) entdeckte die Fähigkeit dieses Organismus, unter bestimmten Bedingungen Cysten auszubilden. Später wurden zwei verschiedene Typen von Cysten unterschieden, die vielleicht jahreszeitlichen Zyklen zuzuordnen sind (Gothe, unveröffentlicht); sicher ist zur Zeit jedoch wohl nur, daß beide Typen nicht gleichzeitig in einer Kultur vorkommen, sondern sich abwechseln. Da einer der beiden "Cysten"-formen jede Art von abgesetzter Hülle fehlt, wird diese im Folgenden nur noch als "Ruhestadium" und nicht mehr als Cyste bezeichnet.
Ruhestadien
Bei den Ruhestadien handelt es sich um sehr unregelmäßig geformte Plasmaansammlungen von 500 - 100 µm Durchmesser, die keine besondere Hülle ausbilden (Abb. 73). Sie entstehen aus Plasmodien, die sich bei Nahrungsmangel, starkem Nahrungsüberangebot oder Kälte am Boden der Kulturgefäße zusammenziehen und dann fragmentieren. Auch nach längerer Lagerung scheinen sich die Ruhestadien nicht in Cysten umzuwandeln; diese entstehen vielmehr unabhängig von den Ruhestadien.
Werden solche Ruhestadien in frisches Medium umgesetzt, so dauert es nur wenige Minuten, bis sich wieder feine Pseudopodien hervorstrecken und ein neues reticulopodiales Netzwerk aufbauen. Die Abbildungen 73a - c zeigen diese Entwicklung in 5-minütigem Abstand.
Das elektronenmikroskopische Bild der Ruhestadien zeigt kaum Unterschiede zu normalen Zellkörpern. Im Überblick (Abb. 75) zeigt die Oberfläche keine besonderen Differenzierungen, die zum Schutz vor ungünstigen Umweltbedingungen dienen könnten. Nur eine feine Schleimhülle wird indirekt durch die aufsitzenden Bakterien deutlich. Im Inneren befinden sich zahlreiche Kerne, die keinen veränderten Eindruck manchen.
Bei stärkerer Vergrößerung (Abb. 76) zeigt das Plasma eine Zellkörper-übliche Struktur, die durch große Mengen dicht gepackten rERs, Reservestoffgranula, Mitochondrien und kleinere Nahrungsvesikel gekennzeichnet ist. Nur ungewöhnlich große Exkretionsvesikel, die aus einer inneren elektronendichten Substanz bestehen, die in ein äußeres, fibrilläres und weniger elektronendichtes Material eingebettet ist, bestehen, fallen auf (Abb. 76). Die Wände dieser Vesikel sind durch viele kleine flaschenförmige Ausstülpungen vergrößert.
Mikrotubuli scheinen in den Ruhestadien zu fehlen; stattdessen findet man große Mengen helikaler Filamente, die größtenteils in Form von Parakristallen angeordnet sind (Abb. 77). Die Aggregate von helikalen Filamenten sind deutlich größer, als in kälteinkubierten Zellen (vgl. Abb. 30) und erreichen fast den Packungsgrad, wie man sie z.B. von Foraminiferen (Hauser & Schwab, 1974) her kennt.
Cysten
Unter ungünstigen Lebensbedingungen können sich aus den Plasmodien von Reticulomyxa Cysten bilden. Man findet sie zumeist, ebenso wie die Ruhestadien, in Kulturen, in denen Nahrungsmangel herrscht. In solchen Kulturen wandern die Zellen häufig an die Wasseroberfläche, segmentieren und fragmentieren innerhalb ihrer Schleimhülle zu kleinen Plasmaarealen, die sich dann abrunden und mit einer festen Hülle umgeben. Die Ausbildung der Cystenhülle ist nach einer Woche abgeschlossen, und es können lichtmikroskopisch keine weiteren Veränderungen mehr beobachtet werden.
Die Cysten von Reticulomyxa sind etwas kleiner (50 - 200 µm) als die Ruhestadien und gleichmäßiger geformt (Abb. 74). Ihr Umriß variiert zwischen kugelförmig bzw. oval bis bohnenförmig. Sie sind zumeist von einer äußeren, gallertartigen Hülle von 20 - 30 µm Dicke umgeben, die sie häufig mit mehreren aus dem gleichen Plasmodium entstandenen Cysten teilen. Stets besitzen sie jedoch eine innere, feste Cystenhülle von 1-2 µm Dicke. Sie überstehen Austrocknung und Einfrieren auf -160C (Gothe, unveröffentlicht) und bilden meist wenige Tage nach dem Wechsel des Kulturmediums wieder ein RPN aus. Den Aufbau der Cystenhülle erkennt man am besten an Cysten, die ihre Hülle wieder verlassen haben (Abb. 74)
Zu Beginn der Cystenbildung zeigt sich im elektronenmikroskopischen Bild keine gegenüber einem normalen Zellkörper veränderte Plasmastruktur. Die Beschaffenheit der Zelloberfläche (Abb. 78) ist normal und auch das innere Cytoplasma ist bis auf das fast vollständige Fehlen von Mikrotubuli nicht von dem vegetativer Zellen zu unterscheiden (Abb. 80). Helikale Filamente, wie in den Ruhestadien, konnten hier trotz intensiver Suche nicht gefunden werden.
Dieses Erscheinungsbild wandelt sich innerhalb der nächsten 1 - 2 Tage vollständig. Die Zelle bildet zahlreiche 20 - 40 nm dicke und ca. 50 nm lange schlauch- bis keulenförmigen Ausstülpungen, die offenbar an dem Aufbau der inneren Cystenhülle beteiligt sind, die zu diesem Zeitpunkt ungefähr 100 nm dick ist und vorwiegend aus fein fibrillärem Material besteht. (Abbildungen 79: Querschnitt; 81: Tangentialschnitt.)
Drei Tage nach Beginn der Cystenbildung ist die innere Cystenhülle schon auf eine Dicke von 400 nm angewachsen (Abb. 83) und das Cystenplasma befindet sich ebenfalls in Umgestaltung. Zahlreiche Zellorganellen (darunter auch Zellkerne, wie Abb. 82 zeigt) werden in großen Autophagosomen abgebaut und ihre Reste verbleiben als dunkel kontrastierte Residualkörper im Plasma. Diese Residualkörper können auch im Lichtmikroskop beobachtet werden und zeigen eine deutliche Bewegung, die ungeordnet zu sein scheint. Das ursprünglich reichlich vorhandene rauhe endoplasmatische Reticulum ist verschwunden; auch größere Mengen freier Ribosomen sind nicht mehr aufzufinden.
Eine Woche später, mit einem Alter von ca. 10 Tagen, ist die Entwicklung der Cysten endgültig abgeschlossen. Die vormals feinfibrilläre Cystenwand wurde weiter verdickt und mit einer inneren Schicht aus dicken, gestreut angeordneten 50 nm-Fibrillen verstärkt (Abb. 84 Inset). Um die Residualkörper haben sich große Mengen von dunkel kontrastierten Reservestoffgranula angeordnet, so daß diese im Querschnitt ein rosettenförmiges Muster bilden (Abb. 84). Die verbliebenen Zellkerne haben keine Nucleoli mehr; rauhes endoplasmatisches Reticulum ist ebenfalls nicht mehr zu sehen.
Dieses Stadium markiert das Ende der Cystenentwicklung; ältere Cysten bis zu einem Alter von 100 Tagen wurden zwar untersucht, zeigten aber keine Veränderung mehr gegenüber den 10 Tage alten.
Da in den Cysten weder Mikrotubuli noch Tubulin-Parakristalle nachweisbar waren, stellt sich die Frage, ob sie überhaupt noch Tubulin enthalten, oder ob dieses bei der Cystenbildung abgebaut worden ist. Daher normal aktive Zellen und Cysten für die PAGE präpariert und die Extrakte wurden auf den gleichen Proteingehalt verdünnt.
Die gefärbten Gele nach der Elektrophorese (Abb. 91) zeigen einige Unterschiede zwischen den Extrakten aktiver Zellen und der Cysten, werden sie jedoch geblottet, so zeigt die Antikörpermarkierung keine wesentlichen Unterschiede zwischen den beiden Extrakten (Abb. 92). Cysten und aktive Zellen enthalten, wie man an der Dicke der im Western Blot mit dem mAK ID5 markierten Banden erkennen kann, in ungefähr die gleiche Konzentration an Tubulin. Die Aufarbeitung, die aktive Zellen enthielt, zeigt jedoch einige weitere Banden von Proteinen mit deutlich geringerem MW als Tubulin, die wahrscheinlich durch Proteolyse hervorgerufen wurden.
In weiteren Versuchen wurde nachgewiesen, daß sich auch die Zusammensetzung der Tubulin-Isotypen im Verlauf der Cystenbildung nicht verändert hat, und die Cystenbildung nicht mit posttranslationalen Modifikationen, insbesondere Tyrosinierung / Detyrosinierung einhergeht. (Siehe den betreffenden Abschnitt.)
Tubulin-Isoformen und ihre Verteilung
In allen Zellen ließen sich bislang stets verschiedene Tubulin-Isoformen und posttranslationale Modifikationen nachweisen. Zwar verfügen Protisten im allgemeinen nur über wenige und einander relativ ähnliche Tubulingene (eine Zusammenstellung findet sich in Luduena, 1993), aber die Genprodukte werden häufig posttranslationell modifiziert. Die bekannteste Modifikation ist die Tyrosinierung / Detyrosinierung (Bulinski & Gundersen, 1991); häufig werden auch Acetylierung (Piperno & Fuller, 1985) und neuerdings auch Polyglycylierung, z.B. bei Paramecium (Levilliers et al., 1995) gefunden.
Schon seit längerem ist bekannt, daß das Tubulin von Reticulomyxa filosa in verschiedener Hinsicht außergewöhnlich ist. Nicht nur das Vorkommen helikaler Filamente (zuerst berichtet von Lindenblatt (1988)) aus polymerem Tubulin, sondern auch sein außergewöhnliches Molekulargewicht (Hauser et al., 1989), sowie das fast vollständige Fehlen eines Tyrosinierungs / Detyrosinierungszyklus, wie er von den meisten anderen Organismen bekannt ist (Hauser et al., 1989) sprechen für eine gewisse Eigenheit des Reticulomyxa-Tubulins. In jüngster Zeit ist dieses Tubulin daher vermehrt Gegenstand verschiedener Untersuchungen geworden (Kube-Granderath & Schliwa, 1996; Linder et al., 1996).
Tubulin-Isoformen in 2D-PAGE und Western Blot
Bestimmung der Molekulargewichte
Das Molekulargewicht der verschiedenen Tubulinformen von Reticulomyxa wurde nach vorausgegangener Elektrophorese im Western Blot bestimmt. Dabei wurden Proteinprobe und Molekulargewichtsmarker gleichzeitig geblottet; die Markerproteine wurden auf den Blots mit Poinceaurot gefärbt und ihre Lage wurde markiert. Daraufhin wurde die Färbung wieder ausgewaschen und die Tubulinbanden wurden mit Antikörpern markiert und ihre Molekulargewichte errechnet. Die Abbildungen 89a bis 89d zeigen das Ergebnis dieses Versuches:
- Der Antikörper ID5, der spezifisch an detyrosiniertes Tubulin bindet (Abb. 89a und 89b), markiert deutlich ein Protein mit einem Molekulargewicht von ungefähr 48 kD. Dies ist erheblich leichter, als vergleichbare a-Tubuline anderer Organismen.
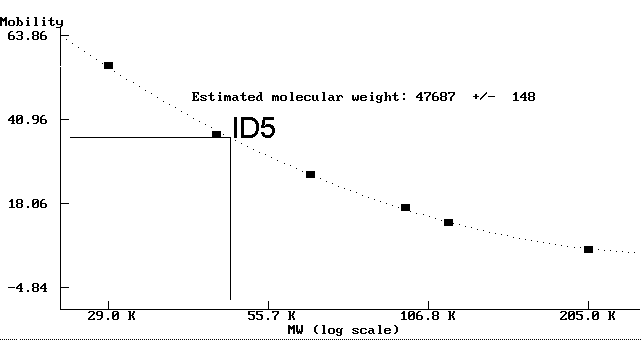 |
Fig. 6: Molekulargewichtsbestimmung des mit dem mAK ID5 markierten Tubulins (ID5[a])Diese Abbildung zeigt anhand des Antigens des mAK ID5, wie die Molekulargewichtsbestimmung mit dem Programm PROTMW durchgeführt wurde. Die schwarzen Quadrate (+) markieren Molekulargewicht und die gemessene Laufstrecke der eingesetzten MW-Marker. Das Programm hat errechnet, daß das Verhältnis Mobilität/log(MW) eher einen hyperbolischen als einen linearen Verlauf hat und hat die ermittelte optimale Ausgleichskurve als punktierte Linie eingezeichnet. Die durchgezogenen Linien zeigen, wie aus der gemessenen Laufstrecke des Antigens des mAK ID5 das resultierende Molekulargewicht errechnet wird. |
- Eine zweite Form von a-Tubulin wird von dem Antikörper TAT1 nachgewiesen. Mit fast 52 kD ist das Molekulargewicht dieses Proteins deutlich von dem durch den mAK ID5 erkannten unterschieden.
| Antikörper | Tubulin | MW (Da) | Schwankung (Da) |
|---|---|---|---|
| ID5(a) | a-glu-Tubulin | 47.687 | +/- 140 |
| ID5(b) | 48.587 | +/- 387 | |
| TAT1 | a-Tubulin | 51.935 | +/- 409 |
| Nr11 | b-Tubulin | 58.058 | +/- 452 |
| Anti-Reticulomyxa-g | g-Tubulin | 45.336 | +/- 452 |
Tabelle 9: Molekulargewichte der verschiedenen Tubulin-Isoformen / Bestimmung in der SDS-PAGEDie Molekulargewichte wurden anhand von mitgeblottetem MW-Markers bestimmt und mit dem Programm PROTMW errechnet. Die Schwankung hängt von der Genauigkeit der zugrundeliegenden Eichmessung ab. Die Gewichtsbestimmung des von dem mAK ID5 erkannten Tubulins wurde auf zwei verschiedenen Blots durchgeführt, daher ergeben sich die Meßwerte (a) und (b). |
|||
- Das b-Tubulin von Reticulomyxa wird von dem Antikörper Nr. 11, der speziell gegen Reticulomyxa b-Tubulin gerichtet ist, erkannt. Die Molekulargewichtsbestimmung ergibt hier 58 kD, was alle bisher bekannten b-Tubuline übertreffen würde. Das b-Tubulin von Reticulomyxa ist, im Gegensatz zu den Verhältnissen bei den meisten anderen Organismen, deutlich schwerer als das a-Tubulin, ein Sachverhalt, der als a/b-Inversion der Tubuline bezeichnet wird und auch von einigen anderen Protisten bekannt ist (Delgado et al., 1991).
- Mit dem Antikörper YL 1/2 gegen tyrosiniertes (physiologisch junges) Tubulin war kein Protein in den Zellextrakten zu markieren, obwohl der Antikörper in Kontrollversuchen mit Hirntubulin deutlich reagierte.
- Das g-Tubulin von Reticulomyxa ist mit 45,5 kD deutlich leichter als die anderen Tubulin-Isoformen. Die Markierung im Western Blot ist stets nur schwach, was auf eine geringere Menge dieses Proteins in der Zelle hinweist.
- Keine Reaktion in Western Blot zeigten die Antikörper: CTR 210 (gegen menschliche Centrosome), Tub 2-28-33 (gegen Seeigel-b-Tubulin), YOL 1/34 (gegen Hefetubulin), 20C6 (gegen tyrosiniertes a-Tubulin), WA3 (gegen b-Tubulin aus Rinderhirn), Anti-g-Tubulin (Joshi) und 6-IIB-1 (gegen acetyliertes a-Tubulin).
Lokalisation des Reticulomyxa-Tubulins in der 2D-PAGE
Um die Tubuline von Reticulomyxa weiter beschreiben und auch hinsichtlich ihres isoelektrischen Punktes charakterisieren zu können, wurde eine zweidimensionale Elektrophorese durchgeführt. In einem ersten Ansatz (Abb. 85) wurde reiner IEP-Marker eingesetzt (Vgl. Tabelle zur Zusammensetzung des IEP-Markers.)
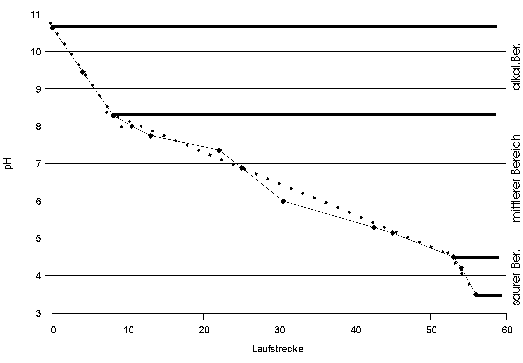 |
Fig. 7: Laufverhalten des IEP-MarkersAuf dem Gel in Abb. 85 wurden die Laufstrecken der IEF-Marker ausgemessen und in dieses Diagramm eingetragen. Auf der Ordinate sind die pH-Werte der Isoelektrischen Punkte der Markerproteine eingetragen; die Abszisse ist in relativen Maßeinheiten geteilt. Man erkennt, daß durch die Stauchung der Enden des IEF-Gels während der Extrusion aus den Glaskapillaren und die Dehnung beim Auflegen auf das SDS-PAGE Gel drei Zonen entstanden sind: An den Randbereichen, bei sehr hohem oder sehr niedrigem pH ist das Gel gestaucht: Einer großen pH-Differenz entspricht eine kleine Differenz der Laufstrecke. Im mittleren pH-Bereich ist das Gel gedehnt. Daher wurden für die Teilbereiche eigene Ausgleichsgeraden (punktierte Linien) ermittelt und zur Abschätzung der IEPs unbekannter Proteine nur benachbarte Markerproteine verwendet. |
In einem weiteren Gel wurden IEP-Marker und Reticulomyxa-Extrakt gemischt, um so prominente Proteine in Reticulomyxa zu finden, deren IEP identisch mit dem von Markerproteinen ist (Abb. 86). Mit Hilfe dieser prominenten Reticulomyxa-Proteine kann bei jeder Probe auch ohne IEP-Marker Zusatz eine Abschätzung des IEP vorgenommen werden (Abb. 87).
Bei weiteren Gelen wurde nach der 2D-PAGE der Kernbereich der Gele ausgestochen und die Proteine wurden wie bei einem normalen Western Blot auf Nitrocellulose übertragen und mit Antikörpern inkubiert. Die zugehörigen Proteinspots auf Silbergelen (Abb. 90) wurden identifiziert und die IEPs anhand von Abb. 87 extrapoliert:
- Der mAK ID5 erkennt zwei Proteine mit identischem MW, die sich geringfügig in ihrem IEP unterscheiden (Abb. 88a). Die häufigere Tubulinform hat einen IEP von 5,3; die seltenere hat einen IEP von näherungsweise 5,25.
- Der Antikörper 27C2 gegen tyrosiniertes Tubulin reagiert schwach mit zwei Tubulin-Isoformen (Abb. 88b), die ebenfalls bei pH 5,3 und 5,25 liegen und die gleiche Häufigkeitsverteilung zeigen, wie sie mit dem mAK ID5 beobachtet wurde. Der Blot wurde daraufhin in einem zweiten Inkubationsschritt mit dem mAK ID5 gegen detyrosiniertes Tubulin behandelt, wobei sich herausstellte, daß dieser zweite Antikörper die gleichen Punkte markierte wie der mAK 27C2 (Abb. 88c).
- Auch in der 2D-PAGE sind die Tubulin-Isoformen, die der mAK TAT1 erkennt, (Abb. 88d) deutlich von denen unterschieden, die der mAK ID5 (27C2) erkennt, was besonders deutlich in der Doppelmarkierung (Abb. 88e) wird. Vielmehr handelt es sich um vier Proteine annähernd identischen MWs, die sich nur geringfügig in ihren isoelektrischen Punkten unterscheiden (5,35 / 5,4 / 5,5 / 5,55).
- Der Antikörper Nr. 11 gegen Reticulomyxa-b-Tubulin erkennt zwei Haupt- und zwei ziemlich schwach ausgeprägte Nebenformen (Abb. 88f), die sich geringfügig in ihrem Gewicht unterscheiden. Die isoelektrischen Punkte liegen bei 5,37 und 5,45 für die Nebenformen und 5,55 sowie 5,75 für die Hauptformen.
- Der Antikörper gegen Reticulomyxa g-Tubulin reagiert nach der 2D-PAGE nur so schwach mit Reticulomyxa-Extrakt, daß kein sicherer Nachweis möglich war.
- Ebenso zeigten jene Antikörper keine Bindung, die schon im Western Blot nach 1-dimensionaler PAGE nicht reagierten.
Vergleich des Tubulingehalts zwischen Cysten und ausgelaufenen Zellen
Um die Frage zu klären, ob sich durch die Bildung von Cysten der Tubulingehalt oder das Verhältnis Glu / Tyr Tubulin ändert, wurden Extrakte von Cysten und ausgelaufenen Zellen hergestellt, auf den gleichen Proteingehalt eingestellt und im Western Blot mit den mAK ID5 und YL 1/2 untersucht.
Es zeigte sich, daß im Verhältnis zum Gesamtproteingehalt in allen Proben gleich viel Tubulin vorhanden ist (Abb. 92a und 92c). Da in den Cysten (s. S. 48) jedoch weder Mikrotubuli noch helikale Filamente zu finden sind, kann das Tubulin nur in Form von freien a/b-Heterodimeren vorliegen.
Auch die Zusammensetzung des Tubulins nach den von den mAK ID5 und YL1/2 erkannten Isoformen (Abb. 92a und 92b) zeigt keine Unterschiede. Die Cysten enthalten also kein von dem mAK YL 1/2 erkennbares tyrosiniertes Tubulin, obwohl die Tyrosinierung durch TTL gerade an freiem Tubulin stattfindet (Beltramo et al., 1987).
Stattdessen ergab der routinemäßige Antikörpertest eine außergewöhnliche Markierung mit dem Antikörper YOL 1/34 (Abb. 92c), der sonst nie mit Reticulomyxa-Tubulin im Western Blot reagierte. Alle Proben, sowohl Cysten, also auch aktive Zellen reagieren schwach mit diesem Antikörper. Die Höhe der Markierung im Verhältnis zu dem als Marker eingesetzten Hirntubulin deutet jedoch darauf hin, daß nicht das mit den mAK ID5 und 27C2 reagierende leichte Tubulin, sondern das normal schwere, sonst nur mit dem TAT1 mAK nachweisbare Tubulin gebunden wurde. Diese Markierung ließ sich jedoch trotz zahlreicher Versuche nicht mehr reproduzieren.
Massenspektrometrische Charakterisierung des Reticulomyxa-Tubulins
Die MW-Bestimmung in der SDS-PAGE wurde mit Hilfe der MALDI-TOF Massenspektroskopie überprüft. Dabei werden die Proteine durch Laserbestrahlung ionisiert und in einem Flugzeit-Massenspektrometer aufgezeichnet.
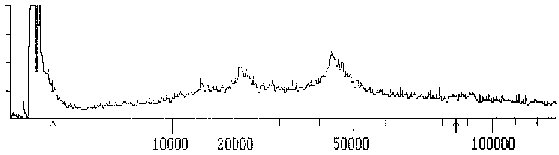 |
Fig. 8: Massenspektrogramm des Tubulins, das mit dem mAK ID5 reagiert - ÜbersichtDieses Spektrogramm zeigt die Massenverteilung einer Messung im MALDI-TOF - Massenspektrometer. Die X-Achse ist logarithmisch skaliert; auf ihr wurde das Molekulargewicht in D aufgetragen; auf der Y-Achse sind relative Arbeitseinheiten angezeichnet. Man sieht am Beginn der Abszisse einen großen Ausschlag, der von den ionisierten Matrixmolekülen (Bernsteinsäure) herrührt. Die Maxima im höhermolekularen Bereich stammen von dem gemessenen Protein. Die Pfeile an der Abszisse markieren den Bereich des Spektrums, der für die folgende Detaildarstellung herausvergrößert wurde. (Summenspektrum aus 11 Messungen) |
Im Vergleich zu Messungen im MALDI-TOF, die mit isolierten Proteinen durchgeführt wurden (vgl. Strupat et al., 1994) sind die Spektren relativ unsauber, was in erster Linie auf die Verunreinigung mit Fremdproteinen zurückzuführen ist; aber auch Proteolyseerscheinungen mögen hierbei eine Rolle spielen. Bei einigen Messungen (z.B. TAT1) sind die relativ breiten Maxima jedoch deutlich gegen den Hintergrund abgesetzt, so daß eine Zusammensetzung aus mehreren verschiedenen Tubulinen, die sich nur geringfügig in der Aminosäurensequenz oder durch posttranslationale Modifikationen unterscheiden, wahrscheinlicher ist.
Das Massenspektrum des Proteins, das mit dem mAK ID5 markiert wird, ist relativ breit und reicht von 43 bis ca. 47 kD mit einem relativ undeutlichen Maximum bei 43,1 kD. Das relativ breite Maximum deutet darauf hin, daß mehrere Isoformen ähnlichen MWs vorliegen.
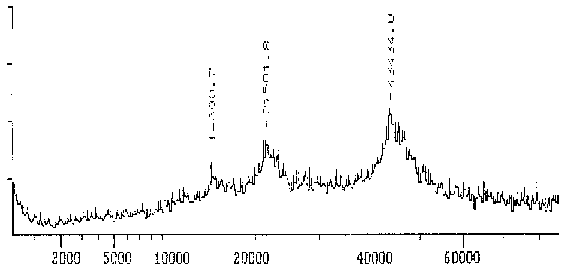 |
Fig. 9 Massenspektrogramm des Tubulins, das mit dem mAK ID5 reagiert - DetailDiese Darstellung ist ein Ausschnitt aus dem Gesamtspektrum, das in der vorhergehenden Abbildung zu sehen ist. Das Hauptmaximum bei 43,4 kD stellt das gemessene Protein dar. Die Nebenmaxima bei MW/2 und MW/3 rühren daher, daß doppelt bzw. dreifach ionisierte Moleküle in einem Massenspektrometer gemessen werden, als ob sie die Hälfte bzw. ein Drittel ihres Gewichtes hätten. Der Wert des Hauptmaximums ist nicht identisch mit dem Molekulargewicht des Proteins. Von den Meßwerten wurde noch ein parallel gemessener Blindwert abgezogen. (Summenspektrum aus 11 Messungen) |
Das von dem mAK TAT1 erkannte Protein erzeugt wiederum ein sehr breites Massenspektrum von 51 bis ca. 53 kD mit einem Maximum bei 51,7 kD, was darauf hin deutet, daß es sich um mehrere Isoformen ähnlichen MWs handelt (wie die 2D-PAGE S. 36 bestätigt).
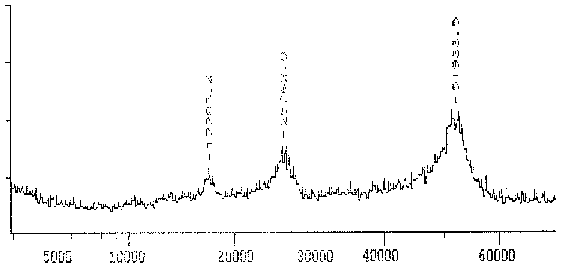 |
Fig. 10 Massenspektrogramm des Tubulins, das mit dem mAK TAT1 reagiert (Ausschnitt aus dem Gesamtspektrum.)Das Hauptmaximum bei 51,9 kD stellt das gemessene Protein dar. Das Maximum ist relativ breit, was auf das Vorhandensein mehrerer ähnlicher Isoformen hindeutet. Zu den zusätzlichen Maxima sowie der Differenz zwischen Maxiumum und Meßwert in der folgenden Tabelle siehe die Erläuterungen zum Spektrum des AK ID5. (Summenspektrum aus 11 Messungen) |
Der Antikörper Nr. 11 gegen Reticulomyxa b-Tubulin hingegen erkennt nur ein Protein mit einem scharfen Maximum bei 53,0 kD. Obwohl dieser Wert deutlich unter dem in der SDS-PAGE bestimmten liegt, bestätigt er doch die generelle Tendenz, daß das b-Tubulin von Reticulomyxa deutlich schwerer als die meisten bekannten anderen b-Tubuline ist.
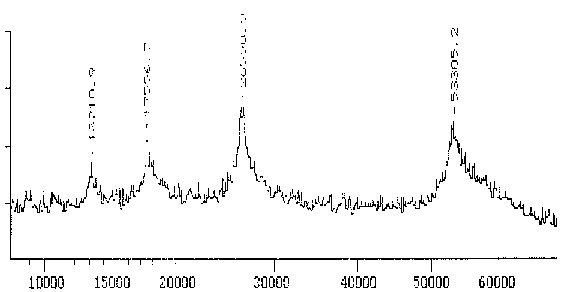 |
Fig. 11 Massenspektrogramm des Tubulins, das mit dem mAK Nr. 11 reagiert (Ausschnitt aus dem Gesamtspektrum.)Das Hauptmaximum bei 53,3 kD stellt das gemessene Protein dar. Zu den zusätzlichen Maxima sowie der Differenz zwischen Maxiumum und Meßwert in der folgenden Tabelle siehe die Erläuterungen zum Spektrum des AK ID5. (Summenspektrum aus 22 Messungen) |
Der polyklonale AK gegen Reticulomyxa g-Tubulin zeigt im MALDI-TOF ebenfalls nur ein schmales Spektrum mit einem sehr deutlichen Maximum um 42,9 kD. Dieses Gewicht ist außergewöhnlich niedrig, bestätigt aber die Tendenz, die schon bei der Messung in der SDS-PAGE erkennbar war. Es scheint nur eine Isoform des g-Tubulins vorzuliegen.
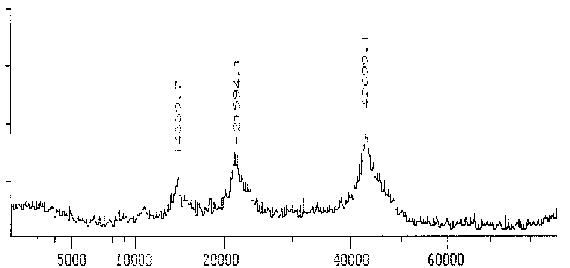 |
Fig. 12 Tubulin, das mit dem Antikörper gegen Reticulomyxa g-Tubulin reagiert (Ausschnitt aus dem Gesamtspektrum.)Das Hauptmaximum bei 42,7 kD stellt das gemessene Protein dar. Zu den zusätzlichen Maxima sowie der Differenz zwischen Maxiumum und Meßwert in der folgenden Tabelle siehe die Erläuterungen zum Spektrum des AK ID5. (Summenspektrum aus 18 Messungen) |
Wie aus diesen Ergebnissen deutlich wird, bestätigen die massenspektroskopischen Messungen im MALDI-TOF zumindest die Tendenzen der Molekulargewichtsbestimmung in der SDS-PAGE.
| Antikörper | Tubulin | MW (Da) | Fehlerbreite (Da) | Anz. Spektren |
|---|---|---|---|---|
| ID5 | a-glu-Tubulin | 243.110 | +/- 280 | 11 |
| TAT1 | a-Tubulin | 51.730 | +/- 290 | 11 |
| Nr11 | b-Tubulin | 53.000 | +/-300 | 22 |
| Anti-Reticulomyxa-g | g-Tubulin | 42.970 | +/-250 | 18 |
Tabelle 10: Molekulargewichte der verschiedenen Tubulin-Isoformen / Bestimmung im MALDI-TOFDie Molekulargewichte wurden im Massenspektrometer bestimmt. Von den Meßwerten, wie sie in den Spektren dargestellt sind, wurde ein separat ermittelter Hintergrundwert abgezogen. Die Fehlerbreite hängt von der Schwankungsbreite der einzelnen gemessenen Spektren ab. Die Anzahl der Spektren gibt an, wieviele Einzelmessungen durchgeführt wurden, um den Meßwert abzusichern. |
||||
Verteilung der Tubulin-Isoformen in der Indirekten Immunfluoreszenz
Die Verteilung von Tubulin-Isotypen oder verschiedenen posttranslationalen Modifikationen des Tubulins kann Aufschluß darüber geben, wie Zellen ihr Cytoskelett auf- oder umbauen (z.B. Zylberberg & Bereiter-Hahn, 1991; Depennart et al., 1988) oder wie stabil verschiedene MT-gestützte Zellstrukturen sind (Arregui & Barra, 1990).
Bei Reticulomyxa war bislang nur bekannt, daß detyrosiniertes Glu-Tubulin vorherrscht. Unter bestimmten Bedingungen soll jedoch auch tyrosiniertes Tubulin in die MT eingebaut werden (Hauser et al., 1989).
a-Tubulin
Der Antikörper ID5 gegen detyrosiniertes Tubulin markiert das gesamte Cytoskelett von Reticulomyxa. Die Markierung erfolgt in feinen, ununterbrochenen Linien, die der erwarteten Anordnung der MT entsprechen (Abb. 94). Der korrespondierende Antikörper YL 1/2, der tyrosiniertes Tubulin erkennt, markiert hingegen keine MT im Cytoskelett der Amöbe (keine Abbildung). Das ändert sich auch nach längeren (2-3 Tage) Inkubationen in 10 mM Taxol nicht. Da bei längeren Inkubationsdauern das Taxol in feinen Kristallen ausfällt, wurde dem Medium zur Erhöhung der Löslichkeit von Taxol 1% DMSO zugesetzt, was jedoch keine Veränderung der fehlenden Markierung mit dem mAK YL 1/2 herbeiführte (keine Abbildungen).
Wird jedoch zur Markierung von tyrosiniertem Tubulin der Antikörper 27C2 eingesetzt (Abb. 95), so zeigt sich das Cytoskelett deutlich und durchgehend markiert. Das gleiche Muster zeigt sich auch mit dem Antikörper 20C6 (Abb. 96), der ebenfalls tyrosiniertes Tubulin erkennt.
Der Antikörper YOL 1/34, der ebenfalls a-Tubulin markiert, aber nicht für eine spezielle Isoform spezifisch ist, zeigt ebenso wie ID5 ein durchgängiges Markierungsmuster (Abb. 97). Allerdings hängt die Markierbarkeit des Cytoskeletts von der Fixierung ab. Nach Methanol- oder Formaldehydfixierung markiert der mAK YOL1/34 nur sehr schlecht. Eine deutliche Markierung der MT wie in Abb. 97 erfolgt nur nach Glutaraldehyd-Fixierung.
Um das unterschiedliche Markierungsverhalten der drei Anti-Tyr-Tubulin mAKs genauer zu untersuchen, wurden einige Doppelmarkierungen durchgeführt. Setzt man zum Beispiel ein Gemisch der beiden Erstantikörper ID5 und 27C2 gleichzeitig ein und markiert nachher mit Zweitantikörpern, die spezifisch nur mit dem Fcg-Fragment des IgG ID5 bzw. der µ-Kette des IgM 27C2 reagieren (Dianova 115-025-071 und 115-015-075; vgl. Zweitantikörpertabelle), so fällt die Markierung mit dem mAK 27C2 (Abb. 100a) sehr viel deutlicher aus als mit dem ID5 (Abb. 100b), der im Vergleich zur alleinigen Inkubation (Abb. 94) deutlich an Intensität eingebüßt hat.
Die Intensität der Markierung mit dem ID5 nimmt jedoch zu, wenn dieser zuerst zu den Zellen gegeben wird und der mAK 27C2 erst nach der Inkubation mit ID5 und dazugehörigem Zweitantikörper in einem zweiten Durchgang hinzugegeben wird (Abb. 101). Sowohl bei simultanem als auch bei sukzedanem Einsatz der beiden Antikörper sind keine MT-Abschnitte eindeutig zu erkennen, die ausschließlich mit einem der beiden Antikörper reagieren.
Eine ähnliche Situation stellt sich dar, wenn der Antikörper 20C6 in einer Doppelmarkierung mit dem mAK YOL 1/34 eingesetzt wird. Während beide Antikörper für sich alleine durchgängige und intensive Markierungen ergeben, überwiegt bei gleichzeitigem Einsatz beider Antikörper die Markierung mit dem mAK 20C6 (Abb. 102). Wird jedoch der schwächere Antikörper, also der mAK YOL 1/34 zuerst eingesetzt und mit dem dazugehörigen Zweitantikörper markiert, bevor als zweiter Erstantikörper der mAK 20C6 eingesetzt wird, so erhöht sich die Markierungsintensität mit dem mAK YOL 1/34 (Abb. 103). Es sind unabhängig von der Reihenfolge des Antikörpereinsatzes keine MT zu erkennen, die eindeutig nur von einem der mAKs markiert werden.
Doppelmarkierungen mit den Antikörpern 20C6 und ID5 sind wegen des identischen Antikörpertyps und der dadurch fehlenden Möglichkeit, spezifische Zweitantikörper einzusetzen, leider nicht möglich. Da beide Antikörper dem Augenschein nach durchgehend alle Mikrotubuli markieren, ist aber auch nicht mit einer Differenz zwischen den Bildern zu rechnen.
Desweiteren reagiert der mAK TAT1 ebenfalls in der IIF mit dem Cytoskelett von Reticulomyxa und zeigt auch eine durchgehende und deutliche Markierung (Abb. 98). Wegen des identischen Ursprungsorganismus der Erstantikörper schied auch hier die Möglichkeit der Doppelmarkierung aus.
Es wurde auch versucht, mit dem mAK 6-IIB-1 gegen acetyliertes a-Tubulin das MT-Cytoskelett zu markieren; offenbar fehlt jedoch dieser posttranslationelle Modifikationstyp vollständig.
Die Markierbarkeit des Cytoskeletts mit den Antikörpern gegen g-Tubulin wurde im Zusammenhang mit dem CTR 210 bereits im Abschnitt über MTOCs abgehandelt (s. S. 32).
b-Tubulin
Das b-Tubulin von Reticulomyxa wird von den meisten kommerziellen Antikörpern nicht erkannt. Einzig der Antikörpern Nr. 11, der spezifisch gegen Reticulomyxa-Tubulin hergestellt worden ist, erkennt dieses Tubulin. Die Markierung ist durchgängig und auf MT beschränkt (Abb. 99).
Zusammenfassung: Tubulin-Isotypen
Die Informationen zu den verschiedenen bei Tubulin-Isotypen bei Reticulomyxa, die durch SDS-PAGE, 2D-PAGE, MALDI-TOF und IIF gewonnen wurden, sind in der folgenden Tabelle zusammengefaßt.
| Tubulintyp | MW (SDS-PAGE) | MW (MALDI-TOF) | MW (Mittelwert) | IEP | Reagiert im Western Blot mit: | Verteilungsmuster in der IIF |
|---|---|---|---|---|---|---|
| a-Tubulin | 47,687 kD
48,587 kD |
43,111 kD | 46,462 kD | pH 5,3 | ID5, 27C2 | durchgehend |
| pH 5,25 | ID5, 27C2 | |||||
| 51,935 kD | 51,730 kD | 51,833 kD | pH 5,35 | TAT1, YOL1/34 (?) 20C6 (?) | durchgehend | |
| pH 5,4 | TAT1, YOL1/34 (?) 20C6 (?) | |||||
| pH 5,5 | TAT1, YOL1/34 (?) 20C6 (?) | |||||
| pH 5,55 | TAT1, YOL1/34 (?) 20C6 (?) | |||||
| b-Tubulin | 58,058 kD | 53,000 kD | 55,529 kD | pH 5,37 | Nr. 11 | durchgehend |
| pH 5,45 | Nr. 11 | |||||
| pH 5,5 | Nr. 11 | |||||
| pH 5,75 | Nr. 11 | |||||
| g-Tubulin | 45,336 kD | 42,970 kD | 44,153 kD | ? | Anti- Reticulomyxa-g | teilweise Punkte, teilweise als diffuser Hintergrund |
Tabelle 11: Zusammenfassung aller Informationen über Tubulin-IsotypenEs wurden zwei verschiedene a-Tubuline und je ein b- und g-Tubulin gefunden. Die Massen wurden mit Hilfe der SDS-PAGE und der MALDI-TOF-Massenspektroskopie bestimmt und ein Mittelwert aus beiden Meßmethoden wurde gebildet. Die Tubuline bestehen zumeist aus mehreren Isotypen, deren IEP ermittelt wurde. |
||||||
Mit den zur Verfügung stehenden Mitteln können zwei nach dem MW verschiedene a-Tubuline und je ein b- und g-Tubulin gefunden werden. Diese Tubuline zeigen in der IEF, daß sie zumeist aus mehreren Isotypen identischen MWs aber unterschiedlicher Eigenladung bestehen. Die Markierung in der IIF ist bei a- und b-Tubulinen immer durchgängig; es gibt keine Hinweise darauf, daß z.B. tyrosiniertes oder detyrosiniertes Tubulin auf bestimmte Bereiche des RPN oder einzelner MT-Bündel beschränkt sein könnte. g-Tubulin kommt hingegen sowohl diffus im Plasma verteilt als auch in einzelnen Punkten vor.
