Zu den gemeinsamen Kennzeichen aller eukaryotischen Zellen gehört neben der Kompartimentierung des Plasmas und der spezifischen Organisation der DNA auch das Vorkommen intrazellulärer stützender Strukturen, die in ihrer Gesamtheit als Cytoskelett bezeichnet werden. Da zu den wichtigsten Aufgaben des Cytoskeletts der Aufbau einer Teilungsspindel und die Verteilung des Erbmaterials auf die Tochterzellen gehört, verwundert es nicht, daß seine Bestandteile, zusammen mit den Histonen, zu jenen Proteinen zählen, die im Lauf der Evolution die geringste Veränderung erfahren haben (Doolittle, 1995). Jede Mutation dieser Proteine könnte für die Zelle fatale Folgen haben.
Neben der Zellteilung, an der auch schon bei prokaryotischen Zellen Vorläufer von Cytoskelettproteinen beteiligt sind (Erickson, 1995), kommen dem Cytoskelett eukaryotischer Zellen in intrazellulärem Transport und der Lokomotion weitere zentrale Aufgaben zu. Wahrgenommen werden diese Aufgaben in wesentlichen von zwei Proteintypen: dem Actin und dem Tubulin.
Actin ist ein globuläres Protein mit einem Molekulargewicht von 42kD, das zumeist in den Zellen in Form von polymeren Filamenten, dem sogenannten F-Actin, vorliegt. Actin ist ein wesentlicher Bestandteil des kontraktilen Apparates der Muskeln, die Grundlage der Plasmaströmung in vielen Algenzellen (Collings et al., 1996; Mineyuki et al., 1995; Menzel et al., 1995; Ryu et al., 1995) und dient der Fortbewegung amöboider Zellen. Die Actinfilamente entstehen durch laterale Anlagerung der hantelförmigen Actin-Monomere in Form einer Helix. Das so entstandene Filament ist polar, was sich auch in unterschiedlichen Gleichgewichtskonstanten für den Einbau neuer Monomere an den Enden zeigt.
Es gibt eine Vielzahl Actin-bindender Proteine, die Actinfilamente untereinander oder mit anderen Zellbestandteilen vernetzen, Actinfilamente stabilisieren, die Enden von Actinfilamenten bedecken (Caping) und damit Auf- und Abbau verhindern, Actinfilamente auflösen oder monomeres Actin stabilisieren (Pollard & Cooper, 1986). Von besonderer Bedeutung ist das Motorprotein Myosin, das sich unter Kraftentfaltung auf Actinfilamenten entlangbewegen kann und so die Basis für die Kontraktion von Muskeln und alle intrazellulären Actin-abhängigen Transportmechanismen bildet. Da Actinfilamente über eine Vielzahl von Proteinen mit den Zellmembranen verbunden sein können (Jockusch et al., 1995), bieten die befestigten Actinfilamente ein stabiles Widerlager für die Kraftentfaltung des Myosins.
Tubulin ist wie Actin von globulärer Form, hat ein Molekulargewicht um 50kD, kommt aber im Cytosol in der Regel nicht als Monomer sondern als Heterodimer aus a- und b-Tubulin vor. Durch longitudinale und laterale Zusammenlagerung parallel orientierter Heterodimere entstehen röhrenförmige Mikrotubuli von ca. 25 nm Durchmesser. In vivo besitzen die meisten MT dreizehn Längsreihen aus hintereinander liegenden Tubulinen, die auch als Protofilamente bezeichnet werden.
Alle neueren Untersuchungen (Song & Mandelkow, 1995; Kikkawa et al., 1994; Maaloum et al., 1994) haben bestätigt, daß die Heterodimere im MT im sogenannten B-Muster angeordnet sind. Das heißt, daß benachbarte Heterodimere mit den gleichen Untereinheiten aneinanderstoßen. Zusätzlich sind die benachbarten Tubuline noch etwas längs gegeneinander versetzt, so daß die räumliche Struktur einer Helix entsteht. Die Steigung dieser Helix beträgt drei Tubuline (also anderthalb Heterodimere) pro Umgang. Dadurch entsteht eine Stelle am MT, an der die benachbarten Tubuline nicht identisch sind. Diese Struktur wird als Saum bezeichnet und scheint eine wichtige Rolle beim Wachsen und Schrumpfen der MT zu spielen (Simon & Salmon, 1990). Im Gegensatz zu älteren Untersuchungen, in denen MT mit anders angeordneten Heterodimeren gefunden worden sein sollen, scheint dieses Muster universell zu sein und z.B. auch für alle MT in Flagellen zu gelten (Song & Mandelkow, 1995).
 |
Fig. 1 Ultrastruktur von MTNeuere Untersuchungen haben bestätigt, daß MT aus dreizehn Protofilamenten bestehen, die im B-Muster in einer 3-start linkshändigen Helix angeordnet sind. Zwischen den Protofilamenten 1 und 13 gibt es einen Saum aus andersartigen Bindungen. |
Der Aufbau aus gleichgerichteten Heterodimeren ist die ultrastrukturelle Grundlage dafür, daß MT zwei verschiedene Enden aufweisen. Die Unterschiedlichkeit dieser Enden äußert sich nicht nur darin, daß an dem einen Ende a- und an dem anderen b-Tubulin exponiert ist, sondern auch in der Fähigkeit, Heterodimere zu binden oder abzugeben.
Bei der Polymerisation lagert sich Tubulin, an das ein GTP gebunden ist, an das Ende von MT an, während bei der Verkürzung GDP-Tubulin abgespalten wird. Die beiden Enden eines MT unterscheiden sich in der Verlängerungsgeschwindigkeit sowie in der Wahrscheinlichkeit, aus einer Phase der Verlängerung in eine der Verkürzung überzugehen (Kowalski & Williams, 1993; Gildersleeve et al., 1992; Erickson & O'Brien, 1992). Man bezeichnet das schnell und mit großer Wahrscheinlichkeit wachsende als das plus-Ende, während man das langsam und mit geringerer Wahrscheinlichkeit wachsende minus-Ende nennt.
Die meisten Mikrotubuli entstehen in vivo jedoch nicht frei, sondern sind mit ihrem minus-Ende an zumeist zentral im Zellkörper liegende Mikrotubuli-organisierende Zentren (MTOCs) gebunden, von denen ausgehend sie auch gebildet werden. Die MTOCs bedecken die minus-Enden der MT und entziehen damit dieses Ende den Auf- und Abbauprozessen. Auch an den plus-Enden der MT finden sich gelegentlich bedeckende Strukturen (Koonce, 1996), die von einigen Autoren ebenfalls als MTOCs bezeichnet werden .
Obwohl die Tubuline sehr konservativ sind (Doolittle, 1995), existieren in den meisten Organismen mehrere unabhängige Kopien der Tubulingene, die sich mehr oder weniger stark unterscheiden (Burns, 1995). Zusätzlich zu den Unterschiedlichkeiten durch abweichende Gensequenzen können sich die Tubuline eines Organismus auch noch durch posttranslationelle Modifikationen unterscheiden, bei denen Tubuline tyrosiniert oder detyrosiniert (Greer & Rosenbaum, 1989; Barra et al., 1988; Bulinski & Gundersen, 1991), acetyliert (Gaertig et al., 1995), phosphoryliert (Wandosell et al., 1987), polyglycyliert (Bressac et al., 1995) oder polyglutamyliert (Fouquet et al., 1996) sind.
Die am längsten bekannte und bisher am genausten untersuchte posttranslationelle Modifikation ist die Tyrosinierung und Detyrosinierung von a-Tubulin (Barra et al., 1973). a-Tubulin ist zumeist mit einem carboxyterminalen Tyrosin codiert (Greer & Rosenbaum, 1989). Dieses terminale Tyrosin wird an den MT zumeist von dem Enzym Tubulin-Carboxypeptidase abgespalten, was dazu führt, daß ältere MT größtenteils aus Tubulin mit einem carboxyterminalen Glu-Rest bestehen (Wehland & Weber, 1987). Nach der Depolymerisation der MT wird an das Glu-Tubulin von dem Enzym Tubulin-Tyrosin-Ligase sehr schnell wieder ein Tyrosin angebaut.
Während die Kinetik der beteiligten Reaktionen genau erforscht ist, blieb die Funktion der Tyrosinierung/Detyrosinierung noch weitgehend unklar. Da die MT um so weniger tyrosiniertes Tubulin enthalten, je physiologisch älter sie sind, nahm man zunächst an, daß die Reaktion selbst die Stabilität von MT regulieren würde. Dies hat sich jedoch nicht bestätigt; die Tyrosinierung von MT ist ein "biochemischer Marker" der MT-Stabilität, aber nicht ihre eigentliche Ursache (Khawaja et al., 1988).
Viele Proteine sind in vivo an MT gebunden, weshalb man sie als Mikrotubulus-assoziierte Proteine (MAPs) bezeichnet. Sie fördern im allgemeinen die Stabilität von MT gegenüber depolymerisierenden Bedingungen oder fördern ihre Polymerisation (Pryer et al., 1992). Die Aufgabe vieler MAPs liegt im intracytoplasmatischen Transport. Ihr Aufbau ist zumeist bipolar: Zwei globuläre Regionen, eine mit einer nucleotidsensitiven MT-Bindestelle, die andere mit einer Bindestelle für das Transportgut, sind durch eine längliche Stielregion miteinander verbunden (Walker & Sheetz, 1993). Die Transportrichtung dieser Motorproteine ist festgelegt; so wandert z.B. Kinesin auf MT nur in Richtung des plus-Endes, während sich Dynein ausschließlich auf das minus-Ende von MT zubewegt.
Durch geeignete Isolationstechniken lassen sich die verschiedenen Motorproteine fast rein gewinnen (Saxton, 1994) und durch Motilitätstests untersuchen. Dabei wird zumeist das Motorprotein an ein Substrat gebunden, und Bewegungsgeschwindigkeit und -richtung zugegebener MT werden gemessen (Cohn et al., 1993). Die Transportraten in Abhängigkeit von der Fähigkeit, bestimmte Nucleotidtriphosphate als Energielieferanten einzusetzen sowie die Hemmung durch spezifische Inhibitoren sind für jeden Motorproteintyp charakteristisch und können zur Identifizierung unbekannter Proteine eingesetzt werden (z.B.: Shimizu et al., 1995). Andere MAPs bündeln MT, so z.B. Tau (Mandelkow et al., 1995; Brandt & Lee, 1993; Moraga et al., 1993) und MAP2 (Ferralli et al., 1994) oder stellen Querverbindungen zum Actin-Cytoskelett her (Pedrotti et al., 1994; Ferhat et al., 1996).
Zur Untersuchung der Eigenschaften des Cytoskeletts eignen sich Protisten oft in besonderem Maße, denn viele Protisten haben in Anpassung an ihre speziellen Lebensbedingungen einzelne Elemente des Cytoskeletts besonders stark herausgebildet und perfektioniert. Zur Untersuchung des MT-Cytoskeletts wurde in dieser Arbeit die nackte, vielkernige Süßwasseramöbe Reticulomyxa filosa eingesetzt, da sie
- ein ausgedehntes, fast nur aus Mikrotubuli bestehendes Cytoskelett besitzt, so daß Untersuchungen weitestgehend ohne Störungen durch andere Cytoskelettelemente durchgeführt werden können.
- Außerdem hat Reticulomyxa filosa das MT-Cytoskelett als Anpassung an die besonderen Lebensumstände perfektioniert. So ist der Auf- und Abbau von MT deutlich schneller als in anderen bekannten Systemen (Chen & Schliwa, 1990) und der bidirektionale Organellentransport findet mit nur einem Motorprotein statt (Schliwa et al., 1991). Daher bietet Reticulomyxa filosa die Chance, aus der einseitigen und extremen Ausbildung des MT-Cytoskeletts Rückschlüsse auf die Organisation und Dynamik von MT in anderen, gewöhnlicheren Organismen ziehen zu können.
- Zusätzlich sind die Zellen auch verhältnismäßig leicht und ohne große Kosten zu kultivieren.
Reticulomyxa filosa wurde erstmals von Nauss (1949) in der Umgebung von New York auf zerfallenden Blättern in der Nähe eines Sumpfes gefunden und beschrieben. Während die Erstbeschreiberin die Art noch in die Verwandtschaft von Myxomyceten und Foraminiferen stellte, ist Reticulomyxa filosa nach der überarbeiteten Nomenklatur von Levine (1980) wie folgt einzuordnen:
- Stamm: Sarcomastigophora
- Unterstamm: Sarcodina
- Klasse: Granuloreticulosea
- Ordnung: Athalamida
Kennzeichen der Art ist die Gliederung in einen zentralen unbeweglichen Zellkörper und ein umgebendes Netzwerk aus feinen, formveränderlichen und untereinander fusionierenden Pseudopodien, das als reticulopodiales Netzwerk bezeichnet wird (Abb. 1). Der Zellkörper ist bei größeren Exemplaren in viele untereinander verbundene fingerförmige Stränge von ca. 100µm Dicke gegliedert, die in ihrer Gesamtheit eine Fläche von bis zu einem Quadratzentimeter bedecken können.
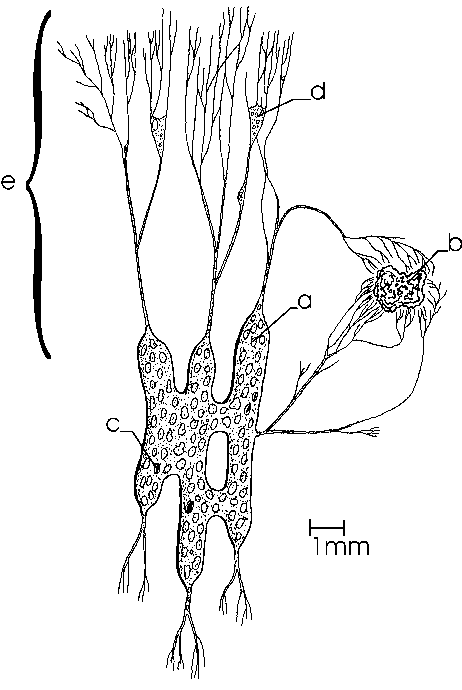 |
Fig. 2 Übersicht über die zelluläre Organisation von Reticulomyxa
|
Den Zellkörper umgibt eine feine Schleimhülle, die zurückbleibt wenn die Zelle sich fortbewegt. Die fein verzweigten Stränge des RPN (Abb. 2) sind mit 10µm bis 0,1µm Durchmesser sehr viel dünner als der Zellkörper und können sich über eine Fläche von vielen Quadratzentimetern erstrecken. In einzelnen Bereichen können die Reticulopodien durch Verschmelzung flache, stellenweise weniger als 0,1µm dicke Lamellipodien bilden, die einen Durchmesser von mehr als 100µm haben können.
In allen Bereichen des RPN kann man außer einer allmählichen und in dem jeweiligen Abschnitt immer gleichgerichteten Plasmaströmung deutlich den gerichteten und bidirektionalen Transport von kleinen Zellorganellen beobachten.
Kern- und Zellteilung bei Reticulomyxa sind unabhängig voneinander. Die Kernteilung erfolgt im gesamten Plasmodium synchron (Schulz, 1991) in Form einer intranucleären Mitose (Hülsmann, 1984). Die Vermehrung erfolgt durch Ausbildung von 2 - 3 Tochterplasmodien (Hülsmann, 1984). Plasmodien einer Population können bei Berührung miteinander verschmelzen; ein sexueller Zyklus ist jedoch nicht bekannt.
Die Zellen sind im Hinsicht auf die Nahrungsaufnahme wenig spezialisiert. In mit TetraMin gefütterten Kulturen konnten Koonce et al. (1986) beobachten, daß die Färbung der Zellen sich mit der Farbe des Futters änderte; dieses wurde also direkt aufgenommen. Gothe (1994) beobachtete, daß Reticulomyxa Flagellaten einfängt, und in den meist zahlreich vorhandenen Nahrungsvakuolen finden sich häufig Bakterien oder Algenzellen.
Die elektronenmikroskopische Beobachtung zeigt, daß die Zusammensetzung des Plasmas im den Bereichen Zellkörper und RPN deutlich unterschiedlich ist. Während beide Bereiche zahlreiche verschiedenartige Vakuolen und Mitochondrien enthalten, sind Zellkerne, Dictyosomen und rauhes endoplasmatisches Reticulum nur auf den Zellkörper beschränkt. Das RPN enthält hingegen meistens deutlich mehr längliche, mit einem ausgeprägten Saum umgebene und teilweise mit elektronendichter Substanz gefüllte "fuzzy coated vesicles".
Das elektronenmikroskopische Bild der gesamten Zelle wird jedoch von zahlreichen parallelen, in Bündeln angeordneten Mikrotubuli bestimmt. Im RPN ist immer ein Großteil der Pseudopodien mit MT erfüllt, während sich durch den Zellkörper verhältnismäßig weniger MT-Bündel ziehen. Obwohl MT das Cytoskelett dominieren, ist bislang ungeklärt, von welcher Zellstruktur sie gebildet werden. Bekannt ist nur, daß kein typisches zentrales MTOC vorhanden ist (Kube-Granderath & Schliwa, 1996; Euteneuer et al., 1989a). Actin wurde in den Plasmodien von Reticulomyxa auch von mehreren Autoren gefunden (Lindenblatt, 1988; Koonce et al., 1986), schien jedoch ähnlich wie Tubulin verteilt und von untergeordneter Bedeutung zu sein.
Erste Versuche von Koonce et. al. (1986) deuteten an, daß der bidirektionale Transport in den feinen Reticulopodien MT-abhängig ist, was später auch an lysierten Zellmodellen bestätigt wurde (Koonce & Schliwa, 1986). Auf der Suche nach den Motorproteinen, die den MT-abhängigen Transport katalysieren, fanden Schliwa et al. (1987) ein putatives Dynein, was sich später dadurch bestätigen ließ, daß die photolytische Spaltung von Dynein mit Hilfe von Vanadat beide Transportrichtungen im RPN von Reticulomyxa-Zellmodellen inhibiert (Euteneuer et al., 1989b). Dies wurde später von Schliwa et al. (1991) bestätigt, die an Zellmodellen Geschwindigkeit, Nucleotidtriphosphat-Abhängigkeit und Hemmbarkeit beider Transportrichtungen maßen und dabei keine signifikanten Unterschiede, wie sie bei dem Vorkommen verschiedener Motorproteine zu erwarten wäre, feststellen konnten.
Wenn diese Ergebnisse zuträfen, wäre nur ein cytoplasmatisches Dynein in Reticulomyxa für beide Transportrichtungen verantwortlich, was unter allen bisher untersuchten Organismen einzigartig wäre. Allerdings stellt sich die Frage, ob das cytoplasmatische Dynein von Reticulomyxa dazu in der Lage ist, auf einem MT sowohl in minus-, als auch in plus-Richtung zu wandern, oder ob es wie in allen bisher untersuchten Organismen ausschließlich in minus-Richtung wandert, aber die MT in Reticulomyxa nicht wie in anderen Zellen ausschließlich mit dem minus-Ende zum Zellkörper hin orientiert sind.
Die ersten Untersuchungen zur Klärung dieser Frage kamen von Koonce & Schliwa (1985), die zeigten, daß auf einem einzelnen MT Transport in beide Richtungen stattfinden konnte. Später wiesen Euteneuer et al. (1989a) mit Hilfe der Dynein-Dekoration nach, daß die cytoplasmatischen MT von Reticulomyxa tatsächlich dem konventionellen Arrangement mit dem minus-Ende proximal zu Zellkörper folgen. Ein Ziel der vorliegenden Arbeit ist es, dieses Ergebnis mit einer anderen Technik, der Dekoration mit Tubulin-Hooks, zu überprüfen.
Die Verlängerung und Verkürzung der feinen Pseudopodien des RPN von Reticulomyxa läuft sehr viel schneller ab, als allein durch die Polymerisation/Depolymerisation von MT erklärbar wäre (Mitchison, 1987). Ein Teil dieses Phänomens wurde dadurch erklärt, daß die MT von Reticulomyxa in Bündeln organisiert sind, und die MT dieser Bündel gegeneinander aktiv verschoben werden können (Koonce et al., 1987). Auch dies ist eine Novität, die mit Ausnahme von Cilien und Flagellen bisher an keinem anderen System beobachtet werden konnte. (Chen & Schliwa, 1990) fanden mit Hilfe von computer-verstärken Videomikroskopaufnahmen heraus, daß Verlängerungsgeschwindigkeiten von bis zu 6,5µm/Sekunde auftreten konnten, von denen unklar ist, wieweit sie auf Polymerisation von MT oder deren Gleitbewegungen beruhen. Die gleichen Autoren fanden, daß MT mit einer Geschwindigkeit von bis zu 19,5µm/Sekunde schrumpfen können. Da bei den schrumpfenden MT meistens beide Enden im Blickfeld lagen, konnten bei diesen Gleitbewegungen ausgeschlossen werden.
Die Frage, die sich aus diesen Beobachtungen ergibt und in dieser Arbeit zumindest teilweise beantwortet werden soll ist daher: Welche speziellen Mechanismen haben die Zellen von Reticulomyxa filosa entwickelt, um diese hohe Dynamik des MT-Cytoskeletts erzielen zu können?
Möglicherweise ist die hohe Dynamik der MT in Reticulomyxa ursächlich mit dem Vorkommen ungewöhnlicher Tubulin-Polymere verknüpft. Durch Behandlung mit Magnesium können die MT einiger Organismen (Welnhofer & Travis, 1996; Shigenaka et al. 1974, zitiert nach Dustin, 1984) in helikale Tubulinfilamente umgewandelt werden, die auch in Reticulomyxa in vivo mit einiger Regelmäßigkeit zu finden sind. Die Produkte dieser Umwandlung ähneln den Tubulin-Polymeren, die durch das Vinca-Alkaloid und Cytostatikum Vinblastin (Nogales et al., 1995b) erzeugt werden. Von einer Untersuchung der Mechanismen, die in Reticulomyxa in vivo zur Entstehung von helikalen Filamenten führen, kann man sich daher vielleicht auch Rückschlüsse auf die Wirkung des Vinblastins erhoffen. Daher war die experimentelle Untersuchung dieser Umwandlung ein weiteres wesentliches Ziel der vorliegenden Arbeit.
Die ungewöhnliche Organisation des Cytoskeletts von Reticulomyxa, die Existenz von bidirektional arbeitenden Motorproteinen und die Fähigkeit, in vivo MT in helikale Filamente umzuwandeln, wirft die Frage auf, ob und wie sich das Tubulin dieses Organismus von dem anderer Zellen unterscheidet. Hauser et al. (1989) beobachteten, daß die MT von Reticulomyxa unter Normalbedingungen kein mit dem mAK YL1/2 nachweisbares tyrosiniertes Tubulin aufweisen, was ein Anzeichen dafür wäre, daß MT nicht depolymerisiert werden, sondern direkt in HF und wieder zurück in MT überführt werden. In letzter Zeit haben Linder et al. (1996) und Kube-Granderath & Schliwa (1996) die Tubulingene von Reticulomyxa isoliert und charakterisiert. Dabei fanden sie insbesondere ein b-Tubulin mit einer ungewöhnlich geringen Sequenzhomologie zu dem anderer Organismen.
In dieser Arbeit sollte untersucht werden, welche Tubulin-Isoformen in Reticulomyxa vorliegen und welchen posttranslationellen Modifikationen sie in vivo unterworfen sind. Das soll Aufschluß darüber geben, ob es bei Reticulomyxa überhaupt wie in anderen Organismen einen Zyklus der posttranslationellen Tyrosinierung/Detyrosinierung von Tubulin gibt, und ob die Isotypen-Zusammensetzung des Tubulins in Reticulomyxa ebenso außergewöhnlich ist wie die Dynamik des Cytoskeletts.
In dieser Arbeit wird des öfteren auf die Foraminifere Allogromia laticollaris (Arnold) Bezug genommen. Dieser sehr gut untersuchte Organismus ist mit Reticulomyxa filosa nicht nur relativ eng verwandt, da er ebenfalls zur Klasse der Granuloreticulosea, dort aber in die Ordnung Foraminifera gehört, sondern er weist auch morphologisch sehr große Ähnlichkeiten mit dem Objekt dieser Arbeit auf. Die Unterschiede beschränken sich auf das Vorkommen eines festen Gehäuses sowie den Foraminiferen-typischen Generationswechsel, der bei Allogromia jedoch noch nicht eindeutig aufgeklärt ist.
Allogromia laticollaris ist ein mariner Organismus mit einem zentralen 70-250µm durchmessenden Gehäuse, der ein RPN von mehreren Millimetern Durchmesser aufbaut (Golz, 1986). Ebenso wie das RPN von Reticulomyxa ist das von Allogromia weitgehend aus MT aufgebaut und enthält nur wenig Actin (Bowser et al., 1988; Travis & Bowser, 1987). Dadurch, daß die Zellkerne in der zentralen Schale verbleiben, ist das Plasma von Allogromia ähnlich dem von Reticulomyxa kompartimentiert; die Ähnlichkeiten in der Ultrastruktur sind so groß, daß es langjährige Erfahrung braucht, um anhand des elektronenmikroskopischen Bildes beide Organismen unterscheiden zu können.
Auch helikale Filamente sind in Allogromia häufig zu finden. Hier wurden sie von Hauser und Schwab (1974) erstmals entdeckt, liegen jedoch häufig in dichter gepackten Aggregaten, den Tubulin-Parakristallen, vor. Schon Hauser und Schwab (1974) wiesen nach, daß es sich bei den parakristallinen Strukturen in Allogromia um Tubulin handele, eine Beobachtung, die durch Rupp et al. (1986) auch immunologisch bestätigt wurde. Die direkte Umwandlung von MT in HF durch Magnesiumchlorid bei Allogromia wurde erst kürzlich von Welnhofer und Travis (1996) ausführlich untersucht.
Der Organellentransport im RPN von Allogromia wurde in mehreren Arbeiten untersucht. Er ist ebenso wie in Reticulomyxa saltatorisch und bidirektional (Travis & Allen, 1981). An den Pseudopodien von Allogromia läßt sich häufig beobachten, daß nicht nur Zellorganellen transportiert werden, sondern auch extrazelluläre Partikel, die in Berührung mit der Membran stehen. Der Transport von Partikeln an der Zellmembran scheint jedoch den gleichen Mechanismen zu unterliegen, wie der intrazelluläre Transport (Bowser & Bloodgood, 1984) und dadurch verursacht zu werden, daß die extrazellulären Partikel zeitweise über die Membran mit Zellorganellen gekoppelt sind, die entlang des RPN transportiert werden (Bowser et al., 1984).
Die Kopplung extrazellulärer Partikel an das Cytoskelett in der Zelle bleibt auch dann noch bestehen, wenn die Membran durch Detergenzien lysiert wird. Der extrazelluläre Transport wird inhibiert, wenn Mikrotubuli-depolymerisierende Agenzien eingesetzt werden (Bowser & Rieder, 1985). Ebenso ist auch der intrazelluläre Partikeltransport in Allogromia durch MT-depolymerisierende Drogen (Kälte, Colchicin oder Nocodazol) vollständig inhibierbar, während die Inkubation mit der Actin-depolymerisierenden Droge Cytochalasin zum Zusammenbruch des RPN und zum ungeordneten Organellentransport führt (Travis & Bowser, 1986; Travis & Bowser, 1987).
Im Gegensatz zu Reticulomyxa verfügen die Zellen von Allogromia zumindest in Teilungsstadien über zentrale MTOCs in Form von Centriolen (Hauser, pers. Mitteilung). Diese Centriole sind jedoch in vegetativen Zellen nicht vorhanden und daher auch nicht an der Organisation der MT beteiligt. Golz & Hauser (1991) fanden an den Enden der MTs von Allogromia häufiger elektronendichte Körper, von denen sie vermuten, daß es sich um mobile MTOCs handeln könne.
Aus dem Vergleich der Cytoskelettorganisation von Reticulomyxa und Allogromia könnten sich neue interessante Schlußfolgerungen ergeben, weil aus der Gegenüberstellung beider Organismen ersichtlicher wird, welche Eigenarten des Cytoskeletts für die Lebensweise und die Organisation des RPN unerläßlich sind, und worin sich die Besonderheiten des einzelnen Organismus zeigen.
In der vorliegenden Arbeit soll die Organisation des Cytoskeletts von Reticulomyxa weiter aufgeklärt werden. Das umfaßt sowohl die Charakterisierung der Actin-Organisation und Funktion, als auch die weitere Untersuchung des MT-Cytoskeletts.
Insbesondere soll geklärt werden, wie sich die Dynamik der MT mit verschiedenen Pharmaka beeinflussen läßt, ob die MT tatsächlich, wie von Euteneuer et al. (1989a) berichtet, größtenteils konventionell mit dem minus-Ende proximal zum Zellkörper orientiert sind und von welchen intrazellulären Strukturen sie organisiert werden. Um die Frage nach den Ursachen der außergewöhnlichen MT-Dynamik in Reticulomyxa beantworten zu können, ist es wichtig, den Mechanismus der Bildung von helikalen Filamenten aus MT weiter aufzuklären. Möglicherweise sind die außergewöhnlichen Eigenschaften der MT von Reticulomyxa mit dem Vorkommen ungewöhnlicher Tubulin-Isoformen verknüpft, daher soll ein Schwerpunkt dieser Arbeit in der Charakterisierung der Tubuline, ihrer Verteilung und ihrer posttranslationellen Modifikationen liegen.
